-
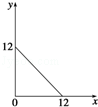
下表中物质的分类组合完全正确的是( )

难度: 简单查看答案及解析
-
已知0.1mol·L﹣1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中
的值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水.
A.①② B.①③ C.②④ D.③④
难度: 中等查看答案及解析
-
下列操作妥当的是( )
A.用托盘天平称量氢氧化钠时,需在左、右托盘上各放一块质量相等的滤纸
B.用25 mL滴定管量取25 mL的氢氧化钠溶液时,需将调好零点的滴定管内所有液体放出
C.用25 mL滴定管量取10 mL氢氧化钠溶液时,下端玻璃导管尖嘴悬挂的液滴不需处理
D.用量筒量取一定量体积的液体配制一定物质的量浓度的溶液时,不要用蒸馏水洗涤量筒后,再将洗涤液移入容量瓶
难度: 中等查看答案及解析
-
相同温度下,根据三种酸的电离常数,下列判断正确的是( )

A.三种酸的强弱关系:HX>HY>HZ
B.反应HZ+Y﹣═HY+Z﹣能够发生
C.相同温度下,0.1 mol·L﹣1的HX、HY、HZ溶液,HX与锌反应一定最快
D.相同温度下,1 mol·L﹣1 HX溶液的电离常数大于0.1 mol·L﹣1 HX
难度: 中等查看答案及解析
-
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是( )
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7
B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7
C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7
D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
难度: 简单查看答案及解析
-
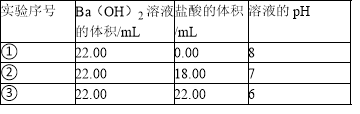
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )

A.c(OH﹣)>c(H ClO)>c(H2CO3)>c(H+)
B.c(OH﹣)>c(HCO3﹣)>c(ClO﹣)>c(H+)
C.c(HClO)+c(ClO﹣)=c(HCO3﹣)+c(H2CO3)
D.c(Na+)+c(H+)=c(HCO3﹣)+c(ClO﹣)+c(OH﹣)
难度: 简单查看答案及解析
-
在一定条件下,Na2CO3溶液中存在水解平衡:CO32﹣+H2O
HCO3﹣+OH﹣。下列说法不正确的是( )
A.通入CO2,溶液pH减小
B.加入少量NH4Cl固体,平衡向正反应方向移动
C.慢慢升高温度,c(HCO3-)/ c(CO32-)逐渐增大
D.加入NaOH 固体,溶液的KW=c(OH﹣)·c(H+)增大
难度: 简单查看答案及解析
-
常温下MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中不正确的是 ( )
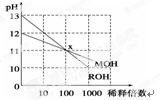
A.ROH是一种强碱,MOH是一种弱碱
B.在x点,c(M+)=c(R+)
C.稀释前,c(ROH)<10c(MOH)
D.稀释前,c(ROH)=10c(MOH)
难度: 简单查看答案及解析
-
已知:25℃时,Mg(OH)2的Ksp=5.61×10﹣12,MgF2的Ksp=7.42×10﹣11,下列判断正确的是( )
A.25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大
B.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
C.25℃时,Mg(OH)2固体在20mL 0.01mol/L的氨水中的Ksp比在20mL0.01mol/L NH4Cl溶液中的Ksp小
D.25℃时,在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
难度: 中等查看答案及解析
-
下列叙述或表示正确的是( )
A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b
B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1
C.难溶电解质AB2的饱和溶液中,c(A2+)=x mol·L﹣1,c(B﹣)=y mol·L﹣1,则Ksp值为4xy2
D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:
3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O
难度: 简单查看答案及解析
-
25℃,向50 mL 0.018 mol/L AgNO3 溶液中加入50 mL 0.02 mol/L 盐酸生成沉淀。已知:Ksp(AgCl)=1.8×10-10,则生成沉淀后的体系中c(Ag+)为( )
A.1.8×10-7mol/L B.1.8×10-8 mol/L C.1.8×10-9mol/L D.1.8×10-10mol/L
难度: 中等查看答案及解析
-
某溶液中在25℃时由水电离出的氢离子浓度为1×10﹣12mol/L,下列说法正确的是( )
A.HCO3﹣离子在该溶液中一定不能大量共存
B.该溶液的pH一定是12
C.向该溶液中加入铝片后,一定能生成氢气
D.若该溶液的溶质只有一种,它一定是酸或碱
难度: 简单查看答案及解析
-
现有KCl和KBr的混合物3.87g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63g沉淀物,则原混合物中钾元素的质量分数为( )
A.24.1% B.25.9% C.40.3% D.48.1%
难度: 中等查看答案及解析
-
在25℃时,向VmLpH=m的HNO3中滴加pH=n的KOH溶液10VmL时,溶液中NO3﹣的物质的量恰好等于加入的K+的物质的量,则m+n的值为( )
A.13 B.14 C.15 D.不能确定
难度: 中等查看答案及解析
-
已知HCN的电离常数K=6.2×10﹣10。用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
A.c(CN﹣)>c(Na+) B.c(CN﹣)>c(HCN)
C.c(HCN)+c(CN﹣)=0.2mol·L﹣1 D.c(CN﹣)+c(OH﹣)=0.1 mol·L﹣1
难度: 简单查看答案及解析
-
硼酸(H3BO3)溶液中存在如下反应:
H3BO3(aq)+H2O(l)
[B(OH)4]–(aq)+H+(aq).下列说法正确的是( )
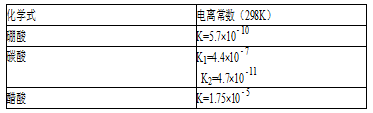
A.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
B.将一滴醋酸溶液滴入碳酸溶液中一定能观察到有气泡产生
C.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
D.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
难度: 简单查看答案及解析
-
室温下,用0.100mol·L﹣1 NaOH溶液分别滴定20.00mL 0.100mol·L﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )

A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
难度: 简单查看答案及解析
-
25℃时,Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12,下列说法正确的是( )
A.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出
B.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl﹣)
C.AgCl和Ag2CrO4共存的悬浊液中,
=
D.向Ag2CrO4的悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgCl
难度: 简单查看答案及解析
-
已知25℃时Ksp[Mg(OH)2]=1.8×10﹣11,Ksp[Fe(OH)3]=8.0×10﹣38,Kb(NH3·H2O)=1.8×10﹣5,下列叙述中不正确的是( )
A.25℃时,向等浓度的MgCl2和FeCl3混合溶液中逐滴加入氨水,先出现红褐色沉淀
B.25℃时,MgCl2溶液中有少量FeCl3时,可以加入MgO进行除杂
C.25℃时,加大量水稀释氨水,电离程度增大,溶液导电能力增强
D.25℃时,NH4++H2O
NH3·H2O+H+的平衡常数为5.6×10﹣10
难度: 简单查看答案及解析