-
下列有关物质分类或归类正确的一组是
① 液氨、液氯、干冰、碘化银均为化合物
② Na2O2、Na2CO3、NaHCO3、Na2SiO3均为钠盐
③ 明矾、小苏打、冰醋酸、次氯酸均为电解质
④ 氢氟酸、盐酸、水玻璃、氨水均为混合物
A. ①和③ B. ②和③ C. ③和④ D. ②和④
难度: 简单查看答案及解析
-
关于下列各实验装置的叙述中,不正确的是
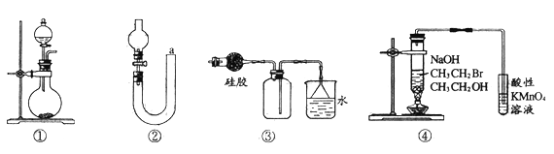
A. 装置①可用于实验室制取少量NH3或O2
B. 可用从a处加水的方法检验装置②的气密性
C. 实验室不可用装置③收集HCl
D. 验证溴乙烷发生消去反应生成烯烃的实验可利用装置④进行
难度: 中等查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是 ( )
A. 强碱性溶液中:CO32-、Na+、AlO2-、NO3-
B. 由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,Na+、K+、Cl-、HCO3-
C. 强碱性的溶液中:K+、Al3+、Cl-、SO42-
D. 酸性溶液中:Fe2+、Al3+、NO3-、I-
难度: 中等查看答案及解析
-
以下实验操作可能会导致实验结果偏高的是
A. 配制一定物质的量浓度的溶液:称量固体时物体与砝码位置颠倒
B. 配制一定物质的量浓度的溶液:定容时仰视刻度线
C. 用浓硫酸与烧碱的稀溶液反应来测定中和热的数值
D. 用10.0mL的量筒量取7.8mL浓硫酸时俯视读数
难度: 简单查看答案及解析
-
假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是
A. 此时16O的相对原子质量为32
B. 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L
C. 标况下44gCO2的体积为22.4L
D. NA个氧分子与NA个氢分子有相同数目的分子
难度: 困难查看答案及解析
-
碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

下列说法正确的是
A. 分离器中的物质分离操作为过滤
B. 膜反应器中,增大压强有利于提高速率和HI的平衡转化率
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+ I2=H2+2H2SO4+2HI
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是
A. 硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-==Fe(OH)3↓
B. 硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-==Fe2S3
C. 过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++NO3-==4Fe2++3H2O+NH4+
D. 硫化氢气体通入氯化铜溶液:S2-+Cu2+==CuS↓
难度: 中等查看答案及解析
-
下列根据实验事实所作结论中,正确的是( )
实验事实
结论
A
A、B两种有机物具有相同的相对分子质量和不同的结构
A、B互为同分异构体
B
质量相同的A、B两种有机物完全燃烧生成质量相同的水
A、B两有机物最简式相同
C
A、B两种有机物结构相似具有相同的通式
A、B互为同系物
D
分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色
A的结构简式可能是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 100g质量分数为46%的乙醇水溶液中含有氧原子数为4NA
B. 若将1 mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA
C. 向大量水中通入1 mol氯气,反应中转移的电子数为NA
D. 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4 g
难度: 困难查看答案及解析
-
分子式分别为
 和适当条件下发生脱水反应其产物可能有( )
和适当条件下发生脱水反应其产物可能有( )A. 5种 B. 6种 C. 7种 D. 8种
难度: 中等查看答案及解析
-
以下关于化学实验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热
②用排水法收集气体后,先移出导管后撤酒精灯
③制取物质时,先检查装置气密性后装药品
④使用容量瓶、分液漏斗、滴定管前,先检查是否漏水后洗涤干净
⑤做H2还原CuO实验时,先通H2后加热CuO;反应完毕后,先撤酒精灯待试管冷却后停止通H2
⑥浓硫酸不慎洒到皮肤上,先用干抹布抹去浓硫酸,然后用大量水冲洗,再涂上3%~5%的NaHCO3溶液
⑦碱液流到桌子上,先加稀醋酸溶液中和,后水洗
⑧点燃可燃性气体如H2、CH4、C2H4、C2H2等时,先检验气体纯度后点燃
A. ①②③⑤⑦⑧ B. ①②③④⑤⑧ C. ①②⑤⑥⑧ D. 全部
难度: 简单查看答案及解析
-
不能鉴别AgNO3、BaCl2、K2SO3和Mg(NO3)2四种溶液(不考虑它们间的相互反应)的试剂组是( )
A. 盐酸、硫酸 B. 盐酸、氢氧化钠溶液
C. 氨水、氢氧化钠溶液 D. 氨水、硫酸
难度: 中等查看答案及解析
-
在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为
,溶质的质量分数为ω,溶质的物质的量浓度为C mol·L-1。则下列叙述中正确的是
①
②
③上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④向上述溶液中加入VmL C mol·L-1的稀盐酸,充分反应后溶液中离子浓度大小关系为: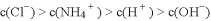
A. ②④ B. ②③ C. ①③ D. ①④
难度: 困难查看答案及解析
-
将质量为W1 g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V1L.向溶液中逐滴加入浓度为a mol·L−1的HCl溶液,过程中有白色沉淀产生后又逐渐溶解,当沉淀恰好消失时所加HCl溶液体积为V2L。将溶液蒸干充分灼烧得到固体(NaCl和Al2O3)W2 g.下列关系式中错误的是
A. 24n(Al)+35.5n(Na)=W2−W1 B. n(Na)+3n(Al)=aV2
C. n(Na)+3n(Al)=V1/11.2 D. aV2=V1/22.4
难度: 困难查看答案及解析
-
已知:SO32﹣+I2+H2O=SO42﹣+2I﹣+2H+。某溶液中可能含有Na+、NH4+、K+、I﹣、SO32﹣、SO42﹣,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A. 肯定不含I﹣ B. 肯定含SO42﹣
C. 肯定含有SO32﹣ D. 肯定含有NH4+
难度: 中等查看答案及解析
-
松香中含有松香酸和海松酸,其结构简式如下图所示。下列说法中,不正确的是

A. 二者互为同分异构体
B. 二者所含官能团的种类和数目相同
C. 二者均能与氢氧化钠溶液反应
D. 二者均能与H2以物质的量之比为1∶3发生反应
难度: 中等查看答案及解析

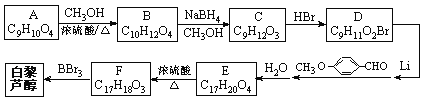
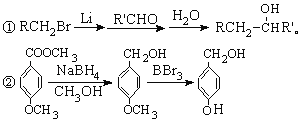
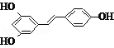 )属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线:
)属二苯乙烯类多酚化合物,具有抗氧化、抗癌和预防心血管疾病的作用.某课题组提出了如下合成路线: