-
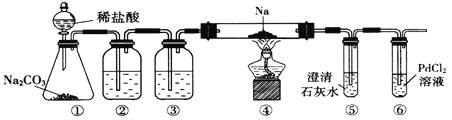
“银-菲洛嗪法”是检测居室内甲醛(化学式CH2O)含量的常用方法之一。化学学习小组利用其原理设计如下装置测定新装修居室内空气中甲醛的含量。(夹持装置略去)
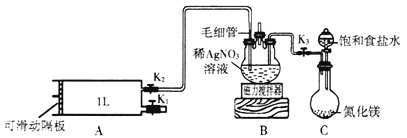
已知:甲醛能被银氨溶液、酸性KMnO4氧化生成CO2;10-5mol·L-1的紫色KMnO4溶液遇甲醛气体即褪色;毛细管内径不超过1mm。
请回答下列问题:
(1)银氨溶液的制备。打开K3,打开分液漏斗活塞,将饱和食盐水慢慢滴入圆底烧瓶中。饱和食盐水的作用是_________________________,当观察到三颈烧瓶中__________时,关闭K3和分液漏斗活塞。
(2)室内空气中甲醛含量的测定
①用热水浴加热三颈烧瓶,打开K1,将滑动隔板慢慢由最右端抽到最左端,吸入1L室内空气,关闭K1。打开K2,缓慢推动滑动隔板,将气体全部推出,关闭K2。装置中毛细管的作用是______________。
再重复上述操作四次。
②向充分反应后的溶液中加入稀硫酸调节溶液pH=1,再加入足量Fe2(SO4)3溶液,写出加入Fe2(SO4)3溶液后发生反应的离子方程式______________________________。立即加入菲洛嗪,Fe2+与菲洛嗪形成有色物质,在562nm处测定吸光度,测得生成Fe2+ 1.12mg。空气中甲醛的含量为___________mg·L-1。
(3)关闭K3,将三颈烧瓶中的溶液换为40.00mL 10-4mol· L-1的KMnO4溶液,量取KMnO4溶液使用的仪器是_____________。再加入2mL 6mol·L-1的硫酸酸化后重新测定空气中甲醛的含量。当三颈瓶中溶液恰好褪色时,向容器A中共抽气________次。
-
碳酸锰(MnCO3)是高性能磁性材料,金属钨是重要的战略物资。由黑钨矿(主要成分为FeWO4、MnWO4,少量SiO2)制取碳酸锰和金属钨的流程如下:
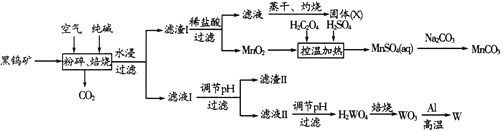
已知:①钨酸(H2WO4)酸性很弱,难溶于水,其钠盐易溶于水。②SiO32-和WO42-完全沉淀的pH分别为8、5。③草酸(H2C2O4)具有酸性和还原性,能分解。
回答下列问题:
(1)将矿石粉碎的目的是_____________________。
(2)固体(X)的化学式是____________________________。
(3)写出高温焙烧过程中,MnWO4发生反应的化学方程式________________。
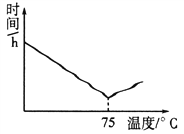
(4)MnO2与硫酸、草酸反应的离子方程式是__________________________。测得一定量MnO2完全溶解的时间与温度的关系如图所示,分析控温加热75℃时MnO2溶解所需时间最少的原因__________________。
(5)滤液Ⅱ调节pH应选择的试剂为_________________。
A.WO3 B.氨水 C.稀盐酸 D.NaHCO3
(6)用Na2CO3溶液沉淀Mn2+时,应控制MnSO4溶液的pH不超过8,防止生成Mn(OH)2,用Na2CO3溶液沉锰采取的操作方法是________________________。
-
直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g) S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
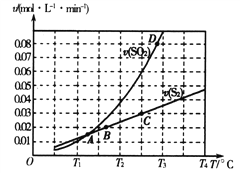
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(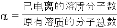 ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的 =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
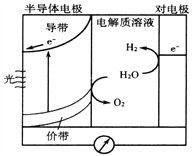
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8
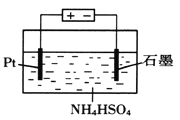
①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
-
Cu、Fe、Se、Co、S、P等元素常用于化工材料的合成。请回答下列问题:
(1)Fe3+最外层电子排布式为___________,其核外共有_____种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是_______________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为_________________(用元素符号表示),SeO2分子的空间构型为___________________。
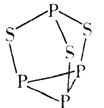
(3)P4S3可用于制造火柴,其分子结构如图所示。P4S3分子中硫原子的杂化轨道类型为__________,每个P4S3分子中含孤电子对的数目为_______________。
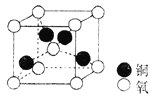
(4)铜的某种氧化物晶胞结构如图所示,若该晶胞的边长为a cm,则该氧化物的密度为________g·cm-3。(设阿伏加德罗常数的值为NA)。
-
化合物G是一种医药中间体,由芳香化合物A制备G的一种合成路线如下:
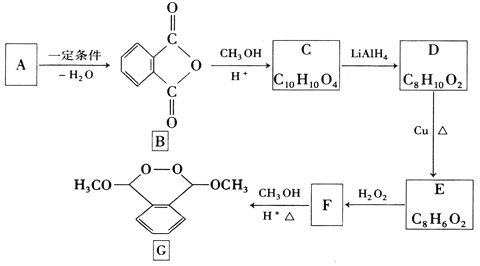
回答下列问题:已知:①酯能被LiAlH4还原为醇
②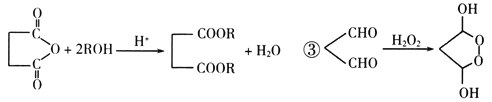
(1)A的化学名称_________________。
(2)C的结构简式_______________,由B生成C的反应类型_____________。
(3)由F生成G的反应方程式_____________________。
(4)芳香化合物X是C的同分异构体,1mol X与足量碳酸氢钠溶液反应生成88g CO2,其核磁共振氢谱显示有3种不同化学环境的氢,峰面积之比为3:1:1的有________种,写出1种符合要求的X的结构简式__________________。
(5)参照上述合成路线,写出用甲醇和苯甲醇为原料制备化合物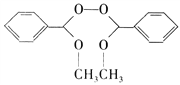 的合成路线__________。
的合成路线__________。





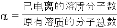 ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的



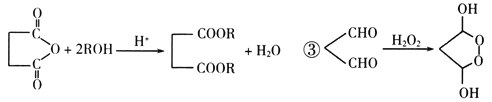
 的合成路线__________。
的合成路线__________。