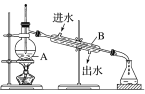
-
对下列实验的评价,正确的是( )
A. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42-
B. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32-
C. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
D. 验证烧碱溶液中是否含有Cl﹣,先加过量的稀硝酸除去OH﹣,再加入AgNO3溶液,如有白色沉淀,则证明有Cl﹣
难度: 中等查看答案及解析
-
下列实验操作先后顺序正确的是:
A. 先装好药品,再检查装置的气密性
B. 结束氢气还原氧化铜的实验时,先停止通氢气后熄灭酒精灯
C. 先将导管插入水中,再用双手握紧试管检查装置气密性
D. 稀释浓硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌
难度: 简单查看答案及解析
-
下列关于物质的量浓度表述正确的是
A. 0.3 mol·L-1的Na2SO4溶液中含有Na+和SO42-的总物质的量为0.9 mol·L-1
B. 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol·L-1,只有当22.4 L(标准状况)氨气溶于水制得1 L氨水时,其浓度才是1 mol·L-1
C. 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 10℃时,100 mL 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol·L-1
难度: 中等查看答案及解析
-
下列溶液中物质的量浓度为1mol/L的是 ( )
A. 将40gNaOH溶解在1L水中
B. 将22.4LHCl气体溶于水配成1L溶液
C. 将1L 10mol/L浓盐酸加入9L水中
D. 将10gNaOH溶解在少量水中,再加蒸馏水至溶液体积为250ml
难度: 简单查看答案及解析
-
滨海新区8.12爆炸事故给我们敲响了安全的警钟,对危险化学品要在包装上有警示标志。下列化学药品与其危险化学品图形标志不一致的一组是

A. 硫磺 B. 高锰酸钾 C. 氢气 D. 乙醇
难度: 简单查看答案及解析
-
化学实验中必须注意安全,以下实验操作或事故处理中正确的是
①在点燃氢气、一氧化碳、甲烷等易燃气体前,必须检验气体的纯度
②做氢气还原氧化铜实验开始时,先通氢气后加热氧化铜
③浓碱液有腐蚀性,如不慎沾到皮肤上,应用较多的水冲洗,再涂上硼酸溶液
④给试管中的液体加热时,液体应不超过试管容积的1/3
⑤点燃装满酒精的酒精灯
A. 仅①②③④ B. 仅①②③ C. 仅①② D. ①②③④⑤
难度: 简单查看答案及解析
-
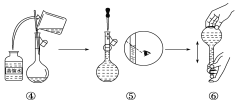
具备基本的化学实验技能是进行科学探究的基础和保证。下列有关实验操作正确的是( )
A.
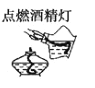 B.
B. 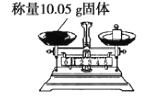 C.
C. 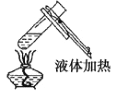 D.
D. 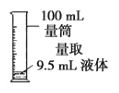
难度: 中等查看答案及解析
-
关于下列物质的分离提纯的方法正确的是
A. 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气
B. 从碳酸钠溶液中得到碳酸钠,可用过滤法
C. 分离酒精与四氯化碳的混合物,可用蒸馏法
D. 从碘的四氯化碳溶液中得到四氯化碳,可用萃取法
难度: 简单查看答案及解析
-
提纯含有少量硝酸钡杂质的硝酸钾溶液,设计实验方案如下,则X试剂为
A. 碳酸钠 B. 碳酸钾 C. 硫酸钠 D. 硫酸钾
难度: 简单查看答案及解析
-
下列物质中混有少量的杂质,所选用的试剂及操作方法正确的是
选项
物质
杂质(少量)
试剂和操作方法
A
二氧化碳
氯化氢
通过氢氧化钠溶液
B
硫酸亚铁溶液
硫酸铜溶液
加入过量的铁粉后过滤
C
氯化钾固体
氯酸钾
加入二氧化锰并加热
D
硝酸钾溶液
硝酸钡溶液
加入适量的硫酸钠溶液后过滤
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列关于胶体的叙述,不正确的是
A. 布朗运动是胶体微粒特有的运动方式,可以据此把胶体、溶液和悬浊液区别开来
B. 光线透过胶体时,胶体发生丁达尔效应
C. 用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D. 向氢氧化铁胶体中滴加硫酸溶液的现象是先形成沉淀后沉淀消失
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 摩尔是化学上常用的一个物理量
B. 一个水分子的质量约等于18÷(6.02×1023)g
C. 3.01×1023个SO2分子的质量约为16g
D. 标准状况下,某物质含有6.02×1023个粒子,则该物质的体积为22.4L
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是
A. 1molCH3+中含有电子数为10NA
B. 在标准状况下,11.2L氖气含有0.5NA个氖原子
C. 物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA
D. 标准状况下,11.2L四氯化碳中含有的分子数为0.5NA
难度: 简单查看答案及解析
-
对于2 mol·L-1的BaCl2溶液,下列叙述正确的是( )
A. 1 L溶液中约含2×6.02×1023个Cl-
B. 取0.5 L该溶液,则c(Ba2+)为1 mol·L-1
C. 0.5 L该溶液中Ba2+和Cl-总数约为3×6.02×1023个
D. 取0.1 L溶液,则Cl-浓度为0.2 mol·L-1
难度: 简单查看答案及解析
-
将36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为cmol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是
A. 所得溶液的物质的量浓度为1mol·L-1
B. 36.5g氯化氢含有NA个原子
C. 36.5gHCl气体占有的体积为22.4L
D. 所得溶液的质量分数w=36.5c÷1000ρ
难度: 简单查看答案及解析
-
某溶液中大量存在以下浓度的五种离子:0.4mol/L Cl﹣、0.8mol/L SO42﹣、0.2mol/L Al3+、0.6mol/L H+、M,则M及其物质的量浓度可能为( )
A. Na+0.6mol/L B. CO32﹣0.2 mol/L
C. Mg2+0.4 mol/L D. Ba2+0.4mol/L
难度: 简单查看答案及解析
-
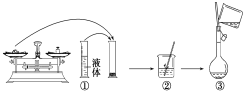
溶质质量分数为98%的浓硫酸(ρ=1.84g/mL),其物质的量浓度为18.4mol/L,取10mL该硫酸与amL水混合,配制成溶质质量分数为49%的硫酸(ρ=1.40g/mL),其物质的量浓度为bmol/L,则a、b分别为( )
A. a>10 b<9.2 B. a<10 b>9.2
C. a=10 b=9.2 D. a>10 b=9.2
难度: 简单查看答案及解析
-
已知Q与R的摩尔质量之比为9:22,在反应X+2Y=2Q+R中,当1.6 g X和Y完全反应后生成4.4 g R,则参与反应的Y和生成物Q的质量之比为( )
A. 46:9 B. 32:9 C. 23:9 D. 16:9
难度: 中等查看答案及解析
-
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子的结构如图所示,下列说法正确的是( )

A.N4属于一种新型的化合物
B.N4与N2的摩尔质量相等
C.等质量的N4与N2所含的原子个数比为1∶1
D.等质量的N4与N2所含的原子个数比为2∶1
难度: 中等查看答案及解析