-
用可溶性钡盐检验SO42-的存在时,先在待测溶液中加入盐酸,其作用是
A. 形成较多的白色沉淀
B. 使形成沉淀的纯度更高
C. 排除SO42-以外的其他阴离子及Ag+的干扰
D. 排除Ba2+以外的其他阳离子的干扰
难度: 中等查看答案及解析
-
2015年8月12日,天津港一处集装箱码头发生爆炸事故,造成大批人员伤亡,事故原因是违规存放爆炸物品。下列图标警示是爆炸物品的是
A.
 B.
B. 
C.
 D.
D. 
难度: 简单查看答案及解析
-
下列说法正确的是
A. 标准状况下,22.4L盐酸中含有NA个HCl分子
B. 直径介于1-100nm之间的粒子称为胶体
C. 碱性氧化物一定是金属氧化物
D. 在一定温度和压强下,气体的体积取决于粒子的大小
难度: 简单查看答案及解析
-
农夫山泉矿泉水标签上印有主要矿物元素含量Ca≥400 K≥35 Mg≥50 Na≥80等(单位:10-6g/100mL),则对此矿泉水的叙述正确的是
A. 该矿泉水能导电
B. 该矿泉水是非电解质
C. 若Ca元素在矿泉水中均以Ca2+形式存在,则 c(Ca2+)≥10-3 mol·L-1
D. 该矿泉水是电解质
难度: 简单查看答案及解析
-
根据阿伏加德罗定律,下列说法中正确的是
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种气体的摩尔质量之比等于密度之比
D. 同温同压下两种气体的物质的量之比等于压强之比
难度: 中等查看答案及解析
-
有0.2 mol·L-1 K2SO4溶液300mL、0.2 mol·L-1 MgSO4溶液200mL和0.2 mol·L-1 Al2(SO4)3溶液100mL,这三种溶液中SO42-物质的量浓度之比是
A. 6:4:3 B. 1:1:1 C. 3:2:3 D. 1:1:3
难度: 简单查看答案及解析
-
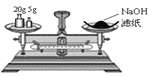

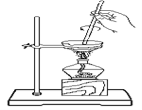
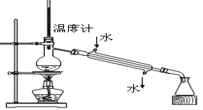
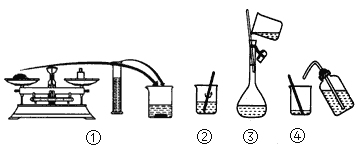
A.称量氢氧化钠固体
B.分离柴油和水
C.把饱和食盐水中的食盐提取出来
D.分离两种互溶但沸点相差较大的液体混合物
难度: 中等查看答案及解析
-
下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为
A. 盐酸、空气、硫酸、氨
B. 蒸馏水、氨水、碳酸氢钠、二氧化硫
C. 胆矾、盐酸、石墨、碳酸钙
D. 生石灰、水煤气、氯化铜、碳酸钠
难度: 简单查看答案及解析
-
下列各组物质相互混合后,会发生反应的是
A. CO2和CaCl2溶液 B. Ca(OH)2和硫酸
C. Na2SO4溶液和MgCl2溶液 D. Na2CO3溶液和NaHCO3溶液
难度: 简单查看答案及解析
-
若某溶液中只含有Na+、Mg2+、SO42-、Cl-四种离子,其中c(Na+):c(Mg2+):c(Cl-)=3:5:5,若c(Na+)=3mol·L-1,则SO42-的浓度为
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
难度: 简单查看答案及解析
-
如图表示某条件下H2S气体的体积与质量的关系,则该条件下的气体摩尔体积为

A. 22.0 L·mol-1 B. 22.4 L·mol-1
C. 23.2 L·mol-1 D. 22.8 L·mol-1
难度: 简单查看答案及解析
-
有一瓶7%的KOH溶液,加热蒸发掉100 g水后,变为14%的KOH溶液80 mL,该80 mL溶液的物质的量浓度为
A. 3.125 mol·L-1 B. 6.25 mol·L-1
C. 6.75 mol·L-1 D. 0.25 mol·L-1
难度: 中等查看答案及解析
-
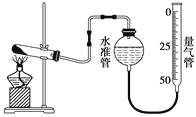
如图实验室某浓盐酸试剂瓶标签上的有关数据,下列说法正确的是
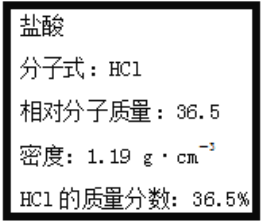
A. 该浓盐酸中HCl的物质的量浓度为11.9mol·L-1
B. 溶液中HCl的物质的量不随所取体积的多少而变化
C. 配制500 mL0.400 mol·L-1的稀盐酸需要量取浓盐酸1.68mL
D. 中和含0.4 g NaOH的NaOH溶液需取0.400 mol·L-1的稀盐酸2.5 mL
难度: 中等查看答案及解析
-
将浓度为2c mol·L-1、质量分数为a%的氨水,加水稀释至浓度为c mol·L-1,质量分数变为b%。则a、b之间的大小关系为 ( 已知:氨水的浓度越大密度越小 )
A. a=2b B. 2b>a>b C. a>2b D. 不能比较
难度: 中等查看答案及解析
-
在透明的强酸性溶液中,能大量共存的离子组是
A. Mg2+、Na+、OH-、SO42- B. K+、Na+、SO42-、HCO3-
C. Ba2+、K+、CO32-、Cl- D. Cu2+、Ca2+、NO3-、Cl-
难度: 简单查看答案及解析
-
下列事实与胶体性质无关的选项个数为
①水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
②将植物油倒入水中用力搅拌形成油水混合物
③夏季的清晨,在密林中经常可以看到一缕缕的光束
④向Fe(OH)3胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解
⑤向豆浆中加入盐卤作豆腐
⑥向FeCl3溶液加NaOH溶液产生红褐色沉淀
A. 2 B. 3 C. 4 D. 5
难度: 简单查看答案及解析
-
下列说法正确的个数是
①做制备蒸馏水的实验时,要在烧瓶里加几粒沸石以防止暴沸
②发现实验室中有大量的可燃性气体泄漏时,应立即开窗通风
③凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂
④分液时将分液漏斗颈上的玻璃塞打开,或是塞上的凹槽(或小孔)对准漏斗上的小孔,再拧开活塞,使液体慢慢沿烧杯壁流下
⑤烧碱溶液不慎沾到皮肤上,立即用大量水冲洗,然后再涂上硼酸溶液
⑥取用化学试剂时,应特别注意观察试剂包装容器上的安全警示标志
A. 6 B. 5 C. 4 D. 3
难度: 简单查看答案及解析
-
下列叙述错误的个数是
①摩尔是国际单位制中七个基本物理量之一
②1 mol任何物质都含有约6.02×1023个分子
③6.02×1023就是阿伏加德罗常数
④氢原子的摩尔质量是1 g
⑤HCl的摩尔质量等于1 mol HCl分子的质量
⑥1 mol H2O中含有1 mol氢分子和1mol氧原子
A. 3 B. 4 C. 5 D. 6
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A. NaOH溶液中通入过量CO2:CO2+2OH-== CO32-+H2O
B. 小苏打溶液中加入少量澄清石灰水:Ca2++2OH-+2HCO3-== CaCO3↓+ CO32-+2H2O
C. 硫酸铜溶液与氢氧化钡溶液混合:Cu2++2OH-== Cu(OH)2↓
D. NaHSO4溶液中加入足量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-== BaSO4↓+2H2O
难度: 中等查看答案及解析
-
密度为d g·cm-3的溶液V mL,含有摩尔质量为M的溶质m g,其物质的量浓度为c mol·L-1,质量分数为W%,下列表示式不正确的是
A. c=1000m/VM B. m=dVW/100
C. d=cM/10W D. W%=cM/1000d%
难度: 中等查看答案及解析