-
(1)下列有关实验的基本操作及安全知识的叙述,正确的是______(填序号).
A.附着于试管内壁的苯酚,可用碱液洗涤 B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
(2)下表是某种常见金属的部分性质:
将该金属投入冷水中无变化,投入稀盐酸中可产生大量的无色气体.试回答:
①推断该金属可能的一种用途______,该金属的活动性比铜______(填“强”或“弱”).
②请自选试剂,设计不同的实验探究该金属与铁的活动性强弱,并完成下表:猜想 验证方法 预测实验现象 ______ ______ ______ ______ ______ ______ 难度: 中等查看答案及解析
-
实验室用图的装置将CO2和CO进行分离和干燥,已知a、b均为活塞,试回答:
(1)甲瓶中装的是______溶液,乙瓶中装的是______溶液,分液漏斗中装的是______;
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是______,活塞操作是______;然后得到______,活塞操作是______.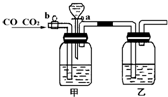
难度: 中等查看答案及解析
-
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:2FeSO4
Fe2O3+SO2↑+SO3↑.
某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量.
(SO2沸点为-10.02℃)请回答相关问题: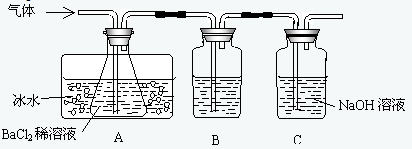
(1)A瓶所盛试剂的作用是______;B瓶所盛的试剂是______;C瓶所盛试剂的作用是______;
(2)A瓶要用冷水冷却的原因是______;
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则______;(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀 C.逸出SO3气体 D.逸出SO2气体
理由是______;
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤)______.难度: 中等查看答案及解析
-
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料.加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解.m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力.写出其中涉及到的化学方程式:______ 2Al2O3、2NH4ClO4
N2↑+4H2O↑+Cl2↑+2O2↑
难度: 中等查看答案及解析
-
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体.用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体.四种盐在不同温度下的溶解度(g/100g水)表①>35℃NH4HCO3会有分解
请回答:温度溶解度盐 0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃ 100℃ NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 39.8 NH4HCO3 11.9 15.8 21.0 27.0 -① - - - NaHCO3 6.9 8.1 9.6 11.1 12.7 14.5 16.4 - NH4Cl 29.4 33.3 37.2 41.4 45.8 50.4 55.3 77.3
(1)反应温度控制在30~35℃,是因为若高于35℃,则______,若低于30℃,则______;为控制此温度范围,采取的加热方法为______;
(2)加料完毕后,继续保温30分钟,目的是______.静置后只析出NaHCO3晶体的原因是______.用蒸馏水洗涤NaHCO3晶体的目的是除去______杂质(以化学式表示);
(3)过滤所得的母液中含有______(以化学式表示),需加入______,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl;
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL.写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______.难度: 中等查看答案及解析
-
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol•L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为______(填化学式);
(2)完成下列过程中的离子反应方程式:
O→C______;D→E______;E→F______;
(3)B值是多少mol?写出计算过程.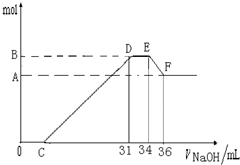
难度: 中等查看答案及解析
-
(I)乙苯的结构简式可以表示为
,如图是一种形状酷似
一条小狗的有机物,化学家Tim Rickard将其取名为“doggycene”.
(1)doggycene分子式为______;
(2)0.5mol该物质在氧气中完全燃烧生成CO2和水,共消耗氧气的物质的量为______mol.
(II)惕各酸苯乙酯(C13H16O2)广泛用作香精的调香剂.为了合成该物质,某实验室的科技人员设计了下列合成路线: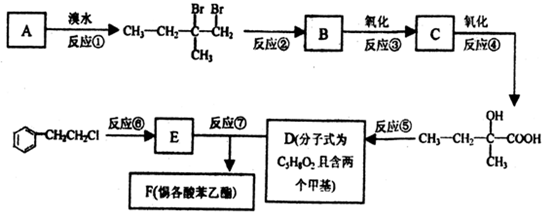
试回答下列问题:
(1)A的结构简式为______;F的结构简式为______;
(2)反应②中另加的试剂是______;反应⑤的一般条件是______;
(3)反应③的化学方程式为:______;
(4)上述合成路线中属于取代反应的是______(填编号).难度: 中等查看答案及解析