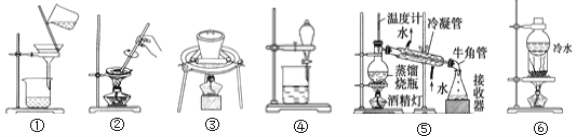
-
某溶液中含有较大量的Cl-、CO32-、OH-3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序中,正确的是
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A. ①②④②③ B. ④②①②③ C. ①②③②④ D. ④②③②①
难度: 中等查看答案及解析
-
为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。不正确的操作顺序是( )
A. ⑤③②①⑤④ B. ⑤③①②⑤④ C. ⑤②③①⑤④ D. ⑤②①③⑤④
难度: 简单查看答案及解析
-
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1 mol N2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是
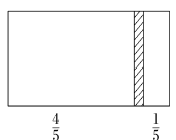
A. 右边与左边分子数之比为4∶1
B. 右侧CO的质量为5.6 g
C. 右侧气体密度是相同条件下氢气密度的14倍
D. 若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入0.2 mol CO
难度: 中等查看答案及解析
-
标准状况下,将V L A气体(摩尔质量为M g/mol
溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为( )
A.
B.
mol/L
C.
+
mol/L D.
mol/L
难度: 中等查看答案及解析
-
在标准状况下,称量一个充满氧气的容器,质量为66.4 g,若改充氮气,其质量为66 g,则容器的容积为( )
A. 4.48 L B. 2.24 L C. 11.2 L D. 5.6 L
难度: 简单查看答案及解析
-
在实验室中,对下列实验事故或药品的处理正确的是( )
A. 汽油失火时,立即用水灭火
B. 加热液体的试管口不能正对着自己或别人
C. 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液擦洗
D. 实验室中含硫酸的废液可以直接倒入水槽,用水冲入下水道
难度: 中等查看答案及解析
-
取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ分别加入汽油、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是
A. Ⅰ中溶液分层,下层呈紫红色
B. Ⅱ中溶液分层,下层呈紫红色
C. Ⅲ中溶液分层,下层呈棕黄色
D. Ⅳ中溶液不分层,溶液由棕黄色变成黄绿色
难度: 中等查看答案及解析
-
在体积为V L的密闭容器中通入a mol CO和b mol O2,一定条件下反应后容器内碳原子数和氧原子数之比为
A. a︰b B. a︰2b C. a︰(a+2b) D. a︰2(a+2b)
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A. 标况下,224 L H2O含有的分子数为10NA
B. 1 mol任何气体所含的原子数均为NA
C. 28 g CO所含的分子数为NA
D. 标况下,NA个分子的体积为22.4 L
难度: 困难查看答案及解析
-
在萃取—分液实验中,振荡分液漏斗的操作正确的是( )
A.
 B.
B. 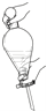 C.
C. 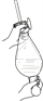 D.
D. 
难度: 中等查看答案及解析
-
下列分离和提纯的实验中,所选用的方法或仪器正确的是 ( )
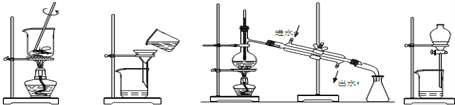
A. 蒸发 B. 过滤 C. 蒸馏 D. 分液
难度: 简单查看答案及解析
-
下列各组中,两种气体的分子数一定相等的是( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的N2和C2H4 D. 压强相同、体积相同的N2和O2
难度: 中等查看答案及解析
-
浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A. 9︰6︰2 B. 9︰3︰1 C. 6︰3︰2 D. 6︰3︰1
难度: 中等查看答案及解析
-
如图是NaCl、NH4Cl和NaHCO3的溶解度曲线,下列说法不正确的是( )
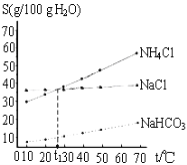
A. t1℃时,饱和NaCl 和NH4Cl 溶液的质量分数相同
B. 相同温度下,NaHCO3在水中的溶解度比NaCl和NH4Cl小很多
C. NH4Cl溶解度随温度变化较大
D. t1℃,饱和NaCl和NH4Cl 溶液的物质的量浓度相同
难度: 中等查看答案及解析
-
下列溶液中溶质的物质的量浓度为1 mol/L的是
A. 将40 g NaOH溶解于1 L水中
B. 将0.25 mol NaOH溶于水配成250 mL溶液
C. 将1 L 10 mol/L的浓盐酸与9 L水混合
D. 将22.4 L氯化氢气体溶于水配成1 L溶液
难度: 中等查看答案及解析
-
质量相同的两种气体A、B,在同温、同压下,A的分子数比B多。下列说法正确的( )
A. A占的体积比B小 B. A的摩尔质量比B大
C. A的密度比B小 D. A的物质的量比B小
难度: 中等查看答案及解析