-
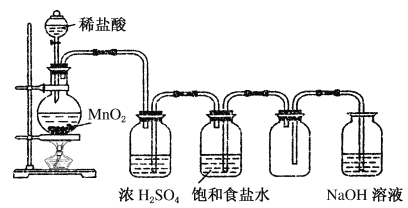
为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。不正确的操作顺序是
A. ⑤②①③⑤④ B. ⑤③①②⑤④ C. ⑤②③①⑤④ D. ⑤③②①⑤④
难度: 中等查看答案及解析
-
有一碘水和Fe(OH)3胶体的颜色极为相似。不用化学方法将它们区别开来,这样的方法有( )
①布朗运动;②丁达尔现象;③加热法;④电泳实验法;⑤加电解质法
A. ①③⑤ B. ①②④⑤ C. ②③④⑤ D. 全部
难度: 中等查看答案及解析
-
某混合溶液由三种物质溶于水制成,且在溶液中一定满足如下关系:c(K+)=c(Cl-),c(Na+)=2c(SO42-),则溶质可能是( )
A. KCl、Na2SO4、H2SO4 B. KCl、Na2SO4、NaC1 C. NaC1、Na2SO4、K2SO4 D. KCl、K2SO4、Na2SO4
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A. 同温同压下,相同体积的两物质,它们的物质的量必相等
B. 任何条件下,等物质的量的氮气和一氧化碳所含的分子数必相等
C. 1L一氧化碳气体的质量一定比1L氧气的质量要小
D. 等体积、等物质的量浓度的强酸中所含的H+数一定相等
难度: 中等查看答案及解析
-
某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是( )
A. 肯定有KNO3和Na2CO3,没有Ba(NO3)2
B. 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C. 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D. 以上判断都不正确
难度: 困难查看答案及解析
-
下列实验操作中正确的是( )
A. 蒸馏时,应将温度计水银球靠近蒸馏烧瓶的支管口
B. 用酒精萃取碘水中的碘
C. 称量NaOH 固体时,将NaOH 固体放在托盘天平左盘的纸上
D. 配制450mL溶液需要用到450mL容量瓶
难度: 中等查看答案及解析
-
体积为1L干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积是
A. 0.25L B. 0.5L C. 0.75L D. 1L
难度: 中等查看答案及解析
-
将ag锌加到VLc mol·L-1的盐酸中,共放出nL氢气(标准状况下),则被还原的HCl的物质的量是( )
A.
mol B.
×10-3 mol C.
mol D. cVmol
难度: 中等查看答案及解析
-
下列关于说法正确的是( )
①常温常压下,22.4 L水中含有的分子数大于NA
②1mol Na2O2与足量CO2充分反应,转移的电子数为2NA
③Na2O2中阴阳离子数目之比与等物质的量的Na2O中阴阳离子数目之比不同
④0.25 mol Na2O2中含有的阴离子数目为0.5NA
⑤NA个氢氧化铁胶体粒子的质量为107g
⑥标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA
⑦常温常压下,28g C2H4与C3H6混合气体所含的原子数6NA
⑧常温常压下,等物质的量浓度的Na2CO3与Na2S溶液中Na+数目相等
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
同温同压下,质量相同的CO2、H2、O2、CH4、SO2五种气体,下列说法错误的是
A. 所占的体积由大到小的顺序是:H2>CH4>O2>CO2>SO2
B. 所含分子数由多到少的顺序是:H2>CH4>O2>CO2>SO2
C. 密度由大到小的顺序是:SO2>CO2>O2>CH4>H2
D. 所含的电子数由多到少的顺序是:CO2>SO2>CH4>O2>H2
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是( )
A. 氢氧化镁与稀硫酸反应:H++OH-=H2O
B. 碳酸钠溶液中通入过量氯气:CO32-+Cl2 = CO2↑+Cl-+ClO-
C. NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2+ +OH-=BaSO4↓+H2O
D. 金属钠投入硫酸镁溶液中:2Na + 2H2O + Mg2+ = 2Na+ + H2↑ + Mg(OH)2↓
难度: 中等查看答案及解析
-
在碱性溶液中能大量共存,且溶液为无色透明的是( )
A. K+、Na+、MnO4-、SO42- B. NH4+、Mg2+、NO3-、SO42-
C. Na+、K+、Cl-、CO32- D. Fe3+、Cu2+、Cl-、SO42-
难度: 中等查看答案及解析
-
一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为
A. 3.0 mol B. 1.5 mol C. 1.0 mol D. 0.75 mol
难度: 中等查看答案及解析
-
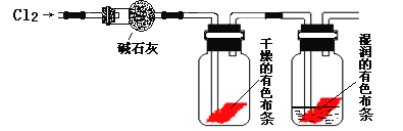
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A. 8∶11 B. 3∶5 C. 1∶2 D. 18∶8
难度: 中等查看答案及解析
-
下列反应中,盐酸既表现出还原性又表现出酸性的是( )
A. CaCO3+2HCl=CaCl2+H2O+CO2↑ B. Fe+2HCl=FeCl2+H2↑
C. MnO2+ 4HCl(浓)
MnCl2+2H2O+ Cl2↑ D. NaOH+HCl=NaCl+H2O
难度: 中等查看答案及解析
-
下列表示反应中电子转移的方向和数目正确的是( )
A.
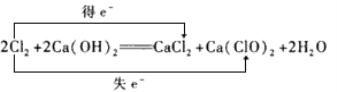
B.
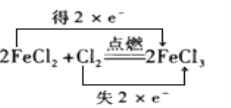
C.

D.

难度: 中等查看答案及解析
-
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4下列关于该反应的说法正确的是( )
A. CuSO4发生了氧化反应 B. 生成1 mol H3PO4时,有10 mol 电子转移
C. 白磷只作还原剂 D. 氧化产物和还原产物的物质的量之比为6∶5
难度: 中等查看答案及解析
-
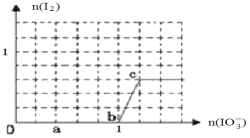
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是(已知硝酸可将Fe2+氧化)( )

A. a点对应的溶液中:Na+、OH-、SO42-、NO3- B. b点对应的溶液中:K+、Ag+、MnO4-、NO3-
C. c点对应的溶液中:Fe2+、Ca2+、NO3-、Cl- D. d点对应的溶液中:K+、Fe2+、NO3-、SO42-
难度: 中等查看答案及解析
-
向27.2Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列说法正确的是( )
A. Cu与Cu2O 的物质的量之比为1:2
B. 产生的NO的体积为4.48L
C. 硝酸的物质的量浓度为2.6mol/L
D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 简单查看答案及解析