-
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物.
A. ②⑤⑨ B. ①②⑤⑦⑨ C. ②④⑤⑥⑦⑨ D. 全部正确
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的是( )
实验目的
实验操作
A
配制1.0mol/LCuSO4溶液
把25g胆矾晶体溶于水配成100mL溶液
B
证明某溶液中含有SO42-
向该溶液中滴入BaCl2溶液
C
实验室制大量CO2
向稀硫酸中加入大理石
D
制备Fe(OH)3胶体
将饱和的FeCl3溶液滴加到热NaOH溶液中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列说法正确的是 ( )
A. 标准状况下, 1.12 L SO3 中含有的质子数目为 2NA
B. 80 mL 10 mol·L-1盐酸与足量 MnO2加热反应,产生Cl2分子数为0.2NA
C. 标况下11.2LNO和11.2LO2混合后所得气体分子数为NA
D. KClO3+6HCl=KCl+3Cl2↑+3H2O 生成3mol Cl2转移5mol电子
难度: 中等查看答案及解析
-
化学与生活、社会发展息息相关,下列有关说法不正确的是( )
A. “雾霾积聚,难见路人”,雾霾所形成的气溶胶有丁达尔效应
B. 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛
C. 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理不相同
D. 碳素钢和光导纤维都属于新型的无机非金属材料
难度: 中等查看答案及解析
-
下列说法正确的是
A. 酸性氧化物一定是非金属氧化物
B. 具有氧化性的物质在反应中一定做氧化剂
C. H2S在不同条件下既能表现还原性,也能表现氧化性
D. 需要加入氧化剂才能实现Cr2O72-、CrO42-的转化
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 酸雨是指pH<7的雨水,酸雨长时间放置,酸性变强
B. 用排空气法收集NO
C. 用加热浓氨水的方法可以快速制氨气,经氯化钙干燥后得到纯净的氨气
D. 8NH3+3Cl2===6NH4Cl+N2,因此可以用浓氨水检验氯气的管道是否漏气
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法一定正确的是 ( )
A. 常温下,1 L 0.1 mol/L的NH4NO3溶液中氧原子数为0.3NA
B. 1 mol的羟基与1 mol的氢氧根离子所含电子数均为10NA
C. 常温、常压下,4.6 g NO2和N2O4混合气体中含有的O原子数目为0.2NA
D. Fe与水蒸气在高温条件下反应,有1 mol Fe参与反应,则转移电子的数目为3NA
难度: 中等查看答案及解析
-
V mL某Na2SO4溶液中含a g Na+,取出V/4 mL溶液稀释成4V mL后,SO42-的物质的量浓度为
A. 125/69V mol·L-1 B. 125a/V mol·L-1 C. 125a/46V mol·L- D. 125a/92V mol·L-1
难度: 中等查看答案及解析
-
已知氧化还原反应反应 K2Cr2O7 + 14HCl
== 2KCl + 2CrCl3 + 3Cl2+ 7H2O。关于该反应的说法中正确的组合是
①氧化剂是K2Cr2O7②还原性:Cl->Cr3+③每生成1molCl2,电子转移为6mol④CrCl3是氧化产物
A. ①② B. ①②④ C. ①③④ D. ①③
难度: 简单查看答案及解析
-
下列图示实验操作,能达到目的的是( )
A.
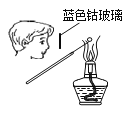 检验K+的存在 B.
检验K+的存在 B. 干燥氯气
C.
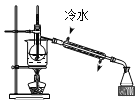 分离酒精与水 D.
分离酒精与水 D. 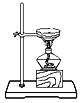 蒸发食盐水
蒸发食盐水难度: 中等查看答案及解析
-
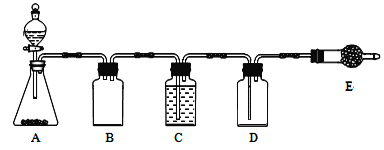
用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是
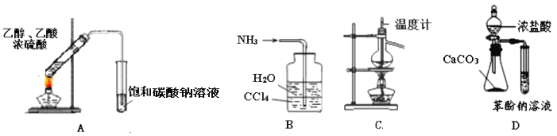
A. 利用A装置制取乙酸乙酯 B. 利用B装置吸收氨气
C. 利用C装置进行石油的分馏 D. 利用D装置比较盐酸、碳酸、苯酚的酸性强弱
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3•H2O
难度: 中等查看答案及解析
-
下列各组离子在指定的溶液中能大量共存的是( )
A. 常温下,水电离的c(OH-)= 1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 能使酚酞变红的溶液中:Na+、Ba2+、HC2O4-、Cl-
C. 0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH−
D. 常温下,
=10-10的溶液中:K+、Na+、I-、SO42-
难度: 中等查看答案及解析
-
某KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,搅拌、过滤,再将滤液按下图所示步骤进行提纯(过滤操作已略去)。下列说法不正确的是
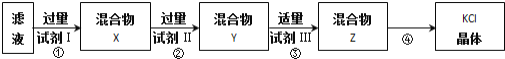
A. 起始滤液常温下pH﹥7 B. 试剂Ⅰ为BaCl2溶液
C. 上图过程必须经2次过滤 D. 步骤③目的是除去CO32-
难度: 中等查看答案及解析