-
化学与社会、生活密切相关,对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
小苏打用作焙制糕点的膨松剂
Na2CO3溶液呈碱性
B
明矾可用于净水
明矾在水中生成的氢氧化铝胶体有吸附性
C
SiO2用于制造光导纤维
SiO2有导电性
D
SO2可使溴水褪色
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是
A. 按系统命名法,化合物
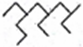 的名称为2, 4-二乙基-丙基辛烷
的名称为2, 4-二乙基-丙基辛烷B. 若两种二肽互为同分异构体,则二者的水解产物一定不相同
C. 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立休结构)有12种
D. 某有机物的结构简式是
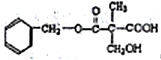 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应
,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应难度: 困难查看答案及解析
-
利用下图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
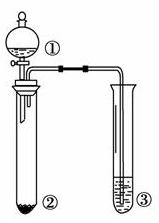
A
浓氯水
NaBr
淀粉KI溶液
氧化性:Cl2>Br2>I2
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
Br2的苯溶液
铁屑
AgNO3溶液
苯与溴单质在铁催化剂作用下
发生取代反应
D
硝酸
Na2SO3
KMnO4溶液
SO2能使KMnO4溶液褪色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 常温常压下,8.8 g CO2和N2O混合气体中所含的电子数为4.4 NA
B. 6.72 L NO2与水充分反应转移的电子数目为0.2 NA
C. 1.0 L 1.0 mol/L的NaAlO2水溶液中含有的氧原子数为2 NA
D. 64 g加热了的铜丝在硫磺蒸气里完全反应后,失去的电子数为2 NA
难度: 中等查看答案及解析
-
我国科学家成功研制出一种全新的铝—石墨双离子电池(AGDIB)。这种新型AGDIB电池采用廉价且易得的石墨作为电池正极材料,铝锂(AlLi)合金作为负极材料,LiPF6是电解质,碳酸酯为溶剂,反应原理是 AlLi + Cx(PF6)
LiPF6 + xC + Al。
下列关于该电池的说法不正确的是
A. 该电池不能用水溶液作为电解质
B. 放电时,Li+在电解质中由负极向正极迁移
C. 充电时,若转移1 mol e—,阴极电极将增重7g
D. 放电时,正极的电极反应式为AlLi-e-=Li+ + Al
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的四种短周期主族元素,X的一种单质具有杀菌、消毒能力,Y单质与X单质在不同条件下反应会生成两种不同化合物,Z简单离子半径是同周期元素简单离子中最小的,W原子最外层电子数是其电子层数的2倍。下列说法不正确的是
A. 气态氢化物的稳定性:X>W
B. Y、Z、W的最高价氧化物对应水化物之间能两两反应
C. 原子半径:Y>Z>W>X
D. 工业上获得Y、Z单质的主要方法是电解其熔融的氯化物
难度: 中等查看答案及解析
-
下列有关电解质溶液的叙述正确的是
A. 室温下,pH均为4的H2SO4、(NH4)2SO4的溶液中,水的电离程度相同
B. 室温时,Ka=1×10-5浓度为0.1 mol/L的HA溶液,pH≈3
C. 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液
增大
D. 25℃时,向20 mL 0.01 mol/L的醋酸溶液中滴加10 mL 0.01 mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)<c(CH3COOH) + c(OH-)
难度: 困难查看答案及解析
 4NO(g) +6H2O(g)
4NO(g) +6H2O(g) 2N2(g) +6H2O(g)
2N2(g) +6H2O(g)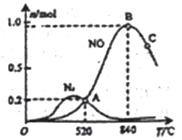
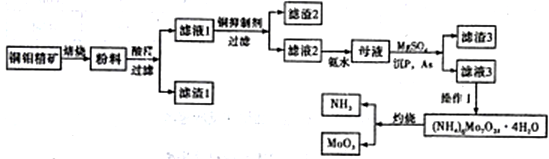
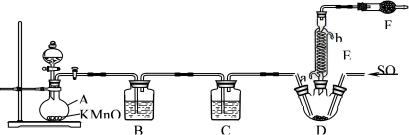
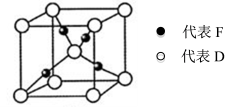
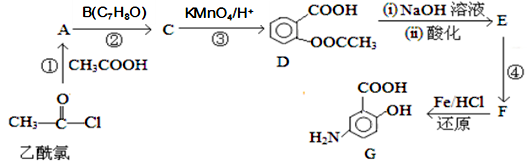
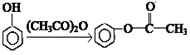 Ⅱ.
Ⅱ.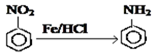 (具有较强的还原性)
(具有较强的还原性)