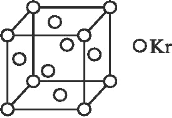
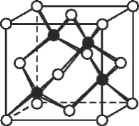
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子
D. 还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
B. Mg(HCO3)2 溶液中加入足量 NaOH 溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
C. 向含有 0.2 mol FeI2 的溶液中通入 0.1 mol Cl2 充分反应:2I-+Cl2=2Cl-+I2
D. 明矾溶液中加入 Ba(OH)2 溶液至生成沉淀的物质的量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列有关反应 3Cl2 + 8NH3=6NH4Cl + N2 的说法中正确的是
A. 若有 0.3 mol Cl2 参加反应,则转移的电子数为 0.6NA
B. 若生成 2.24 L N2,则转移的电子数为 0.6NA
C. 若有 1.2NA 个电子发生转移,则被氧化的 NH3 的质量是 27.2 g
D. 若生成 1 mol NH4Cl 转移的电子数是 n,则 NA=1/n
难度: 中等查看答案及解析
-
下列有关叙述不正确的是
A. 纤维素、酚醛树脂均属于高分子化合物
B. 花生油在碱性条件下的水解,可用于制肥皂
C. 石油的分馏所得的馏分一定都是纯净物
D. 利用渗析原理,用半透膜和蒸馏水可除去淀粉胶体中的食盐
难度: 中等查看答案及解析
-
用 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A. 1molCH4 与 Cl2 在光照条件下反应生成的 CH3Cl 分子数为 NA
B. 5.6g Fe 和 6.4g Cu 分别与足量 Cl2 反应,转移的电子数均为 0.2NA
C. 0.1mol/L 的 FeCl3 溶液中,Fe3+的数目为 0.1 NA
D. 3.0 g 葡萄糖和醋酸的混合物中含有的原子总数为 0.4 NA
难度: 中等查看答案及解析
-
向某 NaOH 溶液中通入 CO2 气体后得到溶液 M,因 CO2 通入的量不同, 溶液 M 的组成也不同,若向溶液 M 中逐滴加入盐酸,产生的气体体积 V(CO2)与加入盐酸的体积 V(HCl)的关系如图所示。则下列分析与判断 不正确的是(不计CO2溶解)

A. 若 OB=0,则形成溶液的过程中所发生反应的离子方程式为OH-+CO2=HCO3-
B. 若 OB=BC,则溶液 M 为Na2CO3 溶液
C. 若 OB>BC,则溶液 M 中大量存在的阴离子为 CO32-和HCO3-
D. 若 3OB=BC,则溶液 M 中 c(NaHCO3)=2c(Na2CO3)
难度: 中等查看答案及解析