-
现有X、Y、Z三种金属,已知:①X和稀硫酸不反应;②Z+H2SO4(稀)═ZSO4+H2↑ ③X+2YNO3═2Y+X(NO3)2,这三种金属的活动性顺序正确的是( )
A. X>Y>Z B. Z>X>Y C. Y>Z>X D. Z>Y>X
难度: 中等查看答案及解析
-
下列各组常见的固体物质中,用水不能区分的是( )
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
难度: 困难查看答案及解析
-
随着世界人口的增长, 人类对农产品的需求量增大,化肥对农作物的增产已成为最有力的措施。现有一包化肥,可能是碳酸氢铵、硫酸铵、磷矿粉、氯化钾中的一种,取少量样品,观察到外观为白色固体,加水后能全部溶解;另取少量样品与熟石灰混合研磨,没有刺激性气体放出,这包化肥是( )
A.碳酸氢铵 B.氯化钾 C.硫酸铵 D.磷矿粉
难度: 中等查看答案及解析
-
有关金属资源叙述正确的是
A. 地球上的金属资源有限,且不可再生
B. 目前世界年产量最多的金属是铝
C. 保护金属资源的唯一途径是防止金属锈蚀
D. 地球上金属资源多以单质形式存在,如金、银、铜
难度: 简单查看答案及解析
-
下列各组固体物质,只用水和组内物质就可相互鉴别的一组是
A. FeCl3、Na2SO4、NaOH、AgNO3
B. CaCO3、Na2CO3、K2CO3、BaCl2
C. NaOH、KNO3、CuSO4、NaNO3
D. BaCl2、CuSO4、MgCl2、NaCl
难度: 中等查看答案及解析
-
生活中废弃的铝制易拉罐、破铁锅、废铜线等可归为一类加以回收,它们属于
A. 化合物
B. 金属或合金
C. 氧化物
D. 非金属
难度: 中等查看答案及解析
-
CuO、稀硫酸、Ba(OH)2溶液、Na2CO3溶液四种物质,在常温下两两混合能发生的化学反应有( )
A. 3个
B. 4个
C. 5个
D. 6个
难度: 中等查看答案及解析
-
实验室模拟工业炼铁中,体现了一氧化碳的
A. 稳定性
B. 氧化性
C. 还原性
D. 酸性
难度: 简单查看答案及解析
-
下列物质与足量稀硫酸反应后,能得到无色、透明的溶液的是
A. CuO
B. Fe(OH)3
C. Fe2O3
D. Na2CO3
难度: 中等查看答案及解析
-
下列关于金属资源的说法中,你不赞成的是
A. 多数金属在地壳中都是以化合物形式存在
B. 地球上的金属资源是取之不尽的
C. 防止金属腐蚀、回收利用废旧金属可以保护金属资源和环境
D. 合理开采矿物、寻找替代品都是保护金属资源的有效途径
难度: 中等查看答案及解析
-
2015年4月10日,南京工业大学科研团队,在有机合成材料中成功观察到“长余辉”现象.并研制出纯有机的“夜明珠”.下列物品所用主要材料属于有机合成材料的是
A.不锈钢汤勺 B.塑料玩具 C.羊毛围巾 D.纯棉T桖
难度: 中等查看答案及解析
-
将下列各组物质的稀溶液混合,不能发生复分解反应的是
A. K2SO4和CuCl2
B. NaOH和CuSO4
C. HCl和Ba(OH)2
D. BaCO3和HCl
难度: 简单查看答案及解析
-
将60℃的硝酸钾溶液降温至20℃,有晶体析出。有关该过程的说法错误的是
A. 60℃时的溶液一定是硝酸钾饱和溶液
B. 20 摄氏度时的溶液一定是硝酸钾的饱和溶液
C. 硝酸钾的溶解度随温度降低而减小
D. 硝酸钾的晶体可采用降温结晶的方法得到
难度: 中等查看答案及解析
-
如图,是A,B两种物质的溶解度曲线,下列说法正确的是
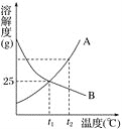
A. A,B两种物质的溶解度都随温度的升高而增大
B. 降低温度可使接近饱和的B溶液变为饱和
C. A,B两种物质的溶解度均为25 g
D. t2℃时,A物质的溶解度大于B物质的溶解度
难度: 中等查看答案及解析
-
现有60 ℃时硝酸钾的饱和溶液,若将其温度降到20 ℃,此时有关该溶液的说法不正确的是
A. 仍为饱和溶液
B. 硝酸钾的溶解度发生了变化
C. 降温前后溶液的质量不变
D. 降温前后溶剂的质量不变
难度: 中等查看答案及解析
-
在一个大萝卜中挖一个大孔,向其中注入一定量的饱和食盐水,过一段时间后将里面的食盐水倒出,再往倒出的食盐水中加入少量食盐晶体。则食盐水的质量会
A. 不变,因为倒出的食盐水还是饱和的
B. 增加,倒出的食盐水还是饱和的,但加入了食盐,故溶液的质量增加
C. 增加,倒出的食盐水不饱和了,加入的食盐会溶解一部分
D. 减少,因为有一部分食盐变成晶体析出
难度: 中等查看答案及解析
-
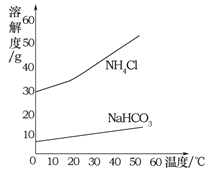
下列实验能达到实验目的是( )
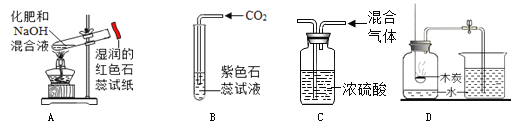
A. 鉴别两种化肥NH4Cl和KNO3 B. 检验二氧化碳
C. 除去氧气中的水蒸气 D. 探究空气中氧气的含量
难度: 中等查看答案及解析
-
用W型玻璃管进行微型实验,如图所示,下列说法错误的是
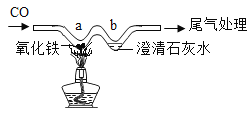
A. a处红色粉末变黑色
B. a处反应为Fe2O3+CO
2Fe+CO2
C. b处石灰水变浑浊证明有二氧化碳生成
D. 可用点燃的方法尾气处理
难度: 中等查看答案及解析
-
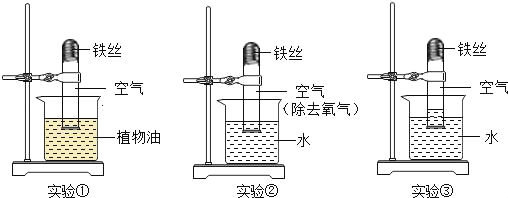
某同学将沾有清水的细铁丝放入图示装置中,一段时间后,可观察到的现象是( )
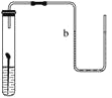
A. 铁丝不变,b液面升高
B. 铁丝不变,b液面不变
C. 铁丝生锈,b液面升高
D. 铁丝生锈,b液面不变
难度: 中等查看答案及解析
-
室温时,将氢氧化钠溶液与盐酸用滴加方式反应时,溶液的pH随滴入溶液体积变化如右下图所示。下列有关说法不正确的是
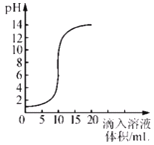
A. 该图像表示的是将氢氧化钠溶液滴入盐酸中
B. 氢氧化钠溶液和盐酸恰好完全反应时。溶液的pH等于7
C. 当滴入溶液的体积为5mL时,所得溶液中的溶质只有NaCl
D. 滴入溶液体积为15mL时,再加几滴紫色石蕊试液溶液呈蓝色
难度: 困难查看答案及解析