-
下列离子方程式的书写及评价均合理的是( )
选项
离子方程式
评价
A
将1molCl2通入到含1molFeI2溶液中:
2Fe2++2I﹣+2Cl2═2Fe3++4Cl﹣+I2
正确;
Cl2过量,可将Fe2+、I﹣均氧化
B
1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+═Al3++Al(OH)3↓+H2O
正确;AlO2﹣与Al(OH)3消耗的H+的物质的量之比为2:3
C
过量SO2通入到NaClO溶液中:
SO2+H2O+ClO﹣═HClO+HSO3﹣
正确;
说明酸性:H2SO3强于HClO
D
Ca(HCO3)2溶液与足量的NaOH溶液反应:
Ca2++HCO3﹣+OH﹣═CaCO3↓+H2O
正确;
酸式盐与碱反应生成正盐和水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对于下列实验现象描述正确的是( )
A. 铁在氧气中燃烧生成红色固体
B. 镁在二氧化碳中燃烧生成白色固体
C. 将过量的NaOH溶液逐滴滴入AlCl3溶液中,先无明显现象后出现白色絮状沉淀
D. 将过量的稀盐酸逐滴滴入稀Na2CO3溶液中,开始几乎不会产生气体,后来出现大量气体。
难度: 中等查看答案及解析
-
下列说法中正确的说法有几个( )
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应 ③增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多 ④有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 ⑤化学反应的实质是旧化学键断裂和新化学键形成的过程 ⑥催化剂能增大活化分子百分数,从而成千成万倍地增大化学反应速率
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
关于一些重要的化学概念有下列说法,其中正确的是
①Fe(OH)3胶体和CuSO4溶液都是混合物
②BaSO4是一种难溶于水的强电解质
③冰醋酸、纯碱、小苏打分别属于酸、碱、盐
④煤的干馏、煤的汽化和液化都属于化学变化
⑤置换反应都属于离子反应
A. ①②⑤ B. ①②④ C. ②③④ D. ③④⑤
难度: 中等查看答案及解析
-
化学与生活、科学、技术、社会、环境密切相关,下列说法中不正确的是
A. 硅单质可作为制造宇宙飞船太阳能电池帆板的主要材料
B. 硫酸铜溶液可用来浸泡蔬菜,以保持蔬菜的新鲜
C. 常用明矾、硫酸铁等物质来处理污水中的悬浮物质
D. 提倡使用共享单车,目的是为了降低碳排放
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的数值。下列说法不正确的是
A. 100 g质量分数为46%的HCOOH溶液中含氢原子数为8 NA
B. 在标准状况下,22.4 LNH3分子中含共用电子对数为3 NA
C. 1 mol SO2与3 mol O2反应生成的SO3分子数为NA
D. 1 L 0.5 mol·L-1葡萄糖溶液中含葡萄糖分子数为0.5 NA
难度: 中等查看答案及解析
-
下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
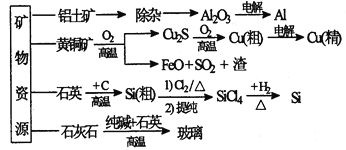
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
难度: 中等查看答案及解析
-
下列四组实验中,操作正确且能达到预期目的是
A. 配制稀硫酸
 B. 固体NaHCO3分解
B. 固体NaHCO3分解
C. 制备Fe(OH)2沉淀
 D. 收集NH3
D. 收集NH3
难度: 中等查看答案及解析
-
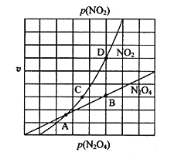
利用如图所示装置可制取H2,两个电极均为惰性电极,c 为阴离子交换膜。下列叙述正确的是

A. a为电源的正极
B. 工作时,OH- 向左室迁移
C. 右室电极反应为:C2H5OH+H2O-4e-=CH3COO-+5H+
D. 生成H2和CH3COONa 的物质的量之比为 2:1
难度: 中等查看答案及解析
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
将SO2通入硝酸钡溶液
产生白色沉淀
SO2与可溶性钡盐均生成白色沉淀
B
向Zn与稀硫酸反应的溶液中滴加硫酸铜溶液
产生气体的速率加快
硫酸铜作该反应的催化剂
C
用铂丝蘸取少量某溶液进行焰色反应
火焰呈黄色
该溶液一定是钠盐溶液
D
蘸有浓氨水的玻璃棒靠近某溶液
有白烟产生
该溶液可能是浓盐酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增加。W原子最外层电子数是其所在周期数的2倍;Y+和X2-的电子层结构相同;Z的原子序数等于W和Y的核外电子数之和。下列说法正确的是
A. Z的氢化物的酸性比WX2的水化物的强,说明Z的非金属性比W的强
B. 离子半径大小:Z>Y>X
C. 工业上用MnO2和Z的氢化物的浓溶液在加热的条件下制取Z的单质
D. 能形成WXZ2这种共价化合物
难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种既能杀菌、消毒,又能絮凝净水的水处理剂。工业制备高铁酸钾的离子方程式为Fe(OH)3+ClO-+OH-
FeO42- +Cl-+H2O(未配平),下列有关说法不正确的是 ( )
A. 由上述反应可知,Fe(OH)3的氧化性强于FeO42-
B. 高铁酸钾中铁显+6价
C. 上述反应氧化剂和还原剂的物质的量之比为3∶2
D. K2FeO4处理水时,不仅能消毒、杀菌,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质
难度: 困难查看答案及解析
-
下列说法正确的是
A. 需要通电才可进行的有:电解、电泳、电离、电镀、电化腐蚀
B. 在Fe(OH)3胶体中滴加稀硫酸的现象为:先沉淀后溶解
C. 用氯化铁溶液和烧碱溶液反应制取氢氧化铁胶体
D. 在Fe(OH)3胶体中插入惰性电极通电,在阳极附近颜色加深
难度: 中等查看答案及解析
-
下列各组离子,在溶液中能大量共存的是
A. S2-、Na+、ClO-、OH- B. Na+、HCO3-、Cl-、H+
C. Na+、Al3+、Cl-、SO42- D. H+、Fe2+、NO3-、SO42-
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)=CO(g)+H2(g)在一密闭容器中进行。下列说法或结论正确的是
A. 当v(CO)(正)=v(H2)(正),时,反应达到平衡状态
B. 其他条件不变,适当增加C(s)的质量会使平衡正向移动
C. 保持容器体积不变,充入少量He使体系压强增大,反应速率一定增大
D. 其他条件不变,仅将容器的体积缩小一半,再次达到平衡时,H2 0(g)的平衡浓度可能是原来的2.1倍
难度: 中等查看答案及解析
-
在恒温、恒容条件下发生下列反应:2X2O5 (g)
4XO2(g) +O2(g) △H>0,T温度下的部分实验数据为:
t/s
0
50
100
150
c(X2O5) mol/L
4.00
2.50
2.00
2.00
下列说法错误的是
A. T温度下的平衡数为K=64 (mol/L)3,100s时转化率为50%
B. 50s 内 X2O5分解速率为 0.03 mol/ (L•s)
C. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2
D. 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变
难度: 中等查看答案及解析
-
某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
难度: 中等查看答案及解析
-
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到的滤液用 NaHCO3溶液处理,测得溶液pH、n[Al(OH)3]随加入NaHCO3溶液体积变化的曲线如下图所示。下列有关说法不正确的是
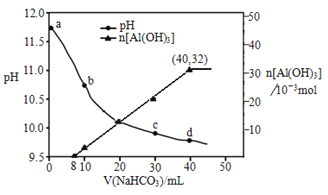
A. 生成沉淀的离子方程式为HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
B. b 点与c点溶液所含微粒种类相同
C. a 点溶液中大量存在的离子是Na+、AlO2-、OH-
D. NaHCO3溶液的物质的量浓度为0.8mol/L
难度: 困难查看答案及解析