-
在 298 K、1.01×105 Pa 下,将 22 g CO2通入 750 mL 1 mol·L-1 NaOH 溶液中充分反应,测得反应放出a kJ 的热量。已知在该条件下,1 mol CO2通入 1 L 2 mol·L-1 NaOH 溶液中充分反应放出b kJ 的热量。则 CO2与 NaOH 溶液反应生成 NaHCO3的热化学方程式为
A. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2b-a)kJ·mol-1
B. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(2a-b)kJ·mol-1
C. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(4a-b)kJ·mol-1
D. CO2(g)+NaOH(aq)===NaHCO3(aq) ΔH=-(8a-2b)kJ·mol-1
难度: 困难查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol-1,则1 mol硫酸与足量氢氧化钡溶液反应放热为114.6 kJ
B. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(1)=2H2(g)+O2(g)反应的△H=+571.6kJ·mol-1
C. 反应物的热效应与是否使用催化剂有关
D. 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g) + 3H2(g) ⇌ 2NH3(g) △H= -38.6 kJ·mol-1
难度: 中等查看答案及解析
-
下列关于能量变化的说法,正确的是( )
A. 将等质量的红磷和白磷完全燃烧生成P2O3(s)放出热量相同
B. 2Na+ 2H2O= 2NaOH+H2 该反应生成物的总能量高于反应物的总能量
C. 放热反应中,反应物的总能量大于生成物的总能量
D. 有化学键断裂的是吸热过程,并且一定发生了化学变化
难度: 中等查看答案及解析
-
下列有关能源的说法不正确的是
A. 光电转换的基本装置就是太阳能电池,应用相当广泛
B. 利用蓝绿藻等低等植物和微生物在阳光作用下可使水分解产生氢气
C. 贮氢合金的发现和应用,开辟了解决氢气贮存、运输难题的新途径
D. 煤、石油、天然气、氢能中,天然气、氢能是可再生能源
难度: 中等查看答案及解析
-
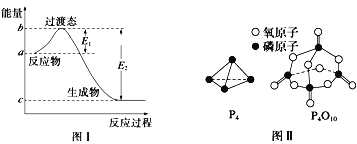
已知下列热化学方程式:
①Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) ΔH1=-26.7 kJ·mol-1
②3Fe2O3(s)+CO(g)= 2Fe3O4(s)+CO2(g) ΔH2=-50.75 kJ·mol-1
③Fe3O4(s)+CO(g)= 3FeO(s)+CO2(g) ΔH3=-36.5 kJ·mol-1
则试通过计算判断,下列有关反应FeO(s)+CO(g)=Fe(s)+CO2(g)的能量变化示意图正确的是
A.
 B.
B. 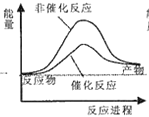 C.
C. 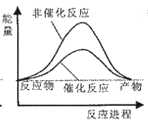 D.
D. 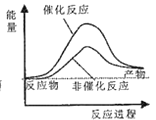
难度: 困难查看答案及解析
-
以下反应中,△H1<△H2的是( )
A. C(s)+l/2O2(g)=CO(g) △H1; C(s)+O2(g)=CO2(g) △H2
B. 2H2(g)+O2(g)=2H2O(g) △H1; 2H2(g)+O2(g)=2H2O(1) △H2
C. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O (1)△Hl;NaOH(aq)+CH3COOH(aq)=CH3COONa (aq)+H2O (1) △H2
D. S(s)+O2(g)=SO2(g) △H1;S(g)+O2(g)=SO2(g) △H2
难度: 困难查看答案及解析
-
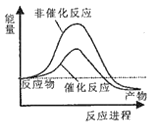
下列说法正确的是
A. Fe和Mg与0.1 mol·L-1的盐酸反应,反应速率相同
B. 0.1 mol·L-1的盐酸与0.1 mol·L-1H2SO4分别与大小、形状相同的大理石反应,反应速率相同
C. 催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
D. 100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
难度: 中等查看答案及解析
-
下列实验事实所引出的相应结论正确的是
选项
实验事实
结论
A
其他条件相同,Na2S2O3 溶液浓度越大, 析出硫沉淀所需时间越短
当其他条件不变时,增大反应物浓度化学反应速率加快
B
在化学反应前后,催化剂的质量和化学性质都没有发生改变
催化剂一定不参加化学反应
C
H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应
反应开始时速率相同
D
在容积可变的密闭容器中发生反应H2(g)+I2(g)
2HI(g),把容积缩小一倍
正反应速率加快,逆反应速率不变
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
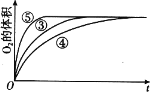
T℃时,在 2 L 的密闭容器中,气体 X、Y 和 Z 三种物质的物质的量随时间变化的曲线如图所示,下列描述正确的是
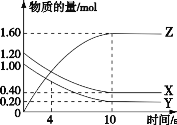
A. 容器中化学反应为 X(g)+Y(g)
Z(g)
B. 0~10 s,X 表示的平均化学反应速率为 0.04 mol/(L·s)
C. 使用催化剂只能加快 0~10 s 间的反应速率
D. 0~4 s 的平均反应速率小于 0~10 s 的平均反应速率
难度: 简单查看答案及解析
-
在2升的密闭容器中,发生以下反应:2A(气)+B(气)
2C气+D(气)。若最初加入的A和B都是4mol,在前10秒钟A的平均反应速度为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
难度: 中等查看答案及解析
-
恒温恒容时,能表示反应 2X(g)+2Y(s)
Z(g) 一定达到化学平衡状态的是
①X、Z 的物质的量之比为 2︰1
②Z 的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成 2nmol Z,同时生成 nmol X
⑤气体平均相对分子质量不变
⑥气体密度不再变化
A. ①②③⑥ B. ①③④⑤ C. ②③⑤⑥ D. ②④⑤⑥
难度: 中等查看答案及解析
-
常温常压下,在带有相同质量活塞的容积相等的甲、乙两容器里,分别充有二氧化氮和空气,现分别进行下列两项实验:(N2O4
2NO2 △H> 0)
(a)将两容器置于沸水中加热 (b)在活塞上都加2 kg的砝码
在以上两情况下,甲和乙容器的体积大小的比较,正确的是 ( )
A. (a)甲>乙,(b)甲>乙 B. (a)甲>乙,(b)甲=乙
C. (a)甲<乙,(b)甲>乙 D. (a)甲>乙,(b)甲<乙
难度: 困难查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
难度: 中等查看答案及解析
-
在密闭容器中发生下列反应 aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D 的浓度为原平衡的 1.75 倍,下列叙述正确的是
A. A 的转化率变大 B. 平衡向正反应方向移动
C. D 的体积分数变大 D. a < c+d
难度: 中等查看答案及解析
-
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g)
2C(g)达到平衡,此时测得n(A)∶n(B)∶n(C)=2∶2∶1。若保持温度不变,以n(A)∶n(B)∶n(C)=2∶2∶1的比例向该容器中再充入A、B和C,下列叙述正确的是
A. 刚充入时反应速率υ正减少,υ逆增大
B. 平衡不发生移动
C. 平衡向逆反应方向移动
D. 物质C的质量分数增大
难度: 困难查看答案及解析