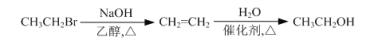
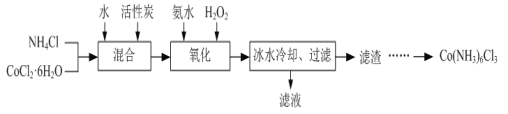
-
下列有关化学用语表示正确的是
A. Na2O的电子式:
B. F-的结构示意图:
C. 中子数为20的Ar原子:
D. 苯甲酸的结构简式:
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的核外有7个电子,在周期表中Y位于ⅡA族,Y、Z原子的最外层电子数之和等于W原子的最外层电子数,W的氢化物热稳定性在同周期元素中最强。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)<r(W)
B. 元素Y、W的简单离子具有相同的电子层结构
C. Z的最高价氧化物对应水化物的酸性比X的强
D. 由X与Y两种元素组成的简单化合物是离子化合物
难度: 困难查看答案及解析
-
高温条件下,Al和Fe2O3反应生成Fe和Al2O3。下列说法正确的是
A. 该反应过程中的能量变化如图所示

B. 该反应条件下,Al的还原性强于Fe
C. 反应中每生成1 mol Fe转移6×6.02×1023个电子
D. 实验室进行该反应时常加入KClO3作催化剂
难度: 中等查看答案及解析
-
炼油厂的废碱液含有废油、苯酚钠、碳酸钠等,实验室通过以下四个步骤处理废碱液获取氢氧化钠固体。下列说法正确的是
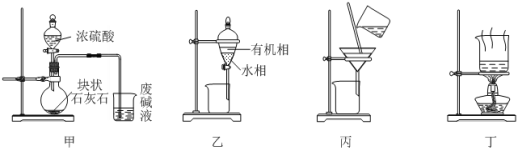
A. 用装置甲制取CO2并通入废碱液
B. 用装置乙从下口放出分液后上层的有机相
C. 用装置丙分离水相中加入Ca(OH)2产生的CaCO3
D. 用装置丁将滤液蒸发结晶得到NaOH固体
难度: 困难查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3
MgCl2(aq)
Mg
B. NaCl(aq)
NaHCO3
Na2CO3
C. Cu2(OH)2CO3
CuO
Cu(OH)2
D. SO2
NH4HSO3
(NH4)2SO4
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. Na2CO3溶液中CO32-水解:CO32-+2H2O
H2CO3+2OH-
B. Al溶于NaOH溶液:Al+2OH-=AlO2-+H2↑
C. Fe3O4溶于稀HNO3:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
D. 向Ba(OH)2溶液中加少量稀H2SO4:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
锌-空气电池(原理如图)适宜用作城市电动车的动力电源。该电池放电时Zn转化为ZnO。该电池工作时下列说法正确的是
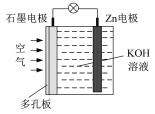
A. 氧气在石墨电极上发生氧化反应
B. 该电池的负极反应为Zn+H2O-2e-=ZnO+2H+
C. 该电池放电时OH-向石墨电极移动
D. 该电池充电时应将Zn电极与电源负极相连
难度: 中等查看答案及解析
-
莨菪亭是一种植物生长激素,其结构简式如图所示。下列有关莨菪亭的说法正确的是
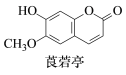
A. 分子中只含有一个手性碳原子
B. 分子中所有碳原子可能处于同一平面
C. 该物质能发生加成、取代和消去反应
D. 1 mol该物质最多能与2mol NaOH反应
难度: 困难查看答案及解析
-
(题文)下列说法正确的是
A. 铜的金属活泼性比铁的弱,可在海轮外壳上镶入若干铜块以减缓其腐蚀
B. 向0.1 mol·L-1CH3COONa溶液中加入少量水,溶液中
减小
C. 一定温度下,增大反应2BaO2(s)
2BaO(s)+O2(g)容器的体积,平衡不移动
D. 反应TiO2(s) + 2Cl2(g)=TiCl4(g) + O2(g) ΔH>0能自发进行,其原因是ΔS>0
难度: 中等查看答案及解析

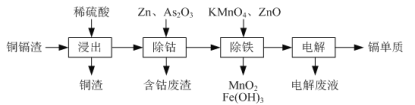
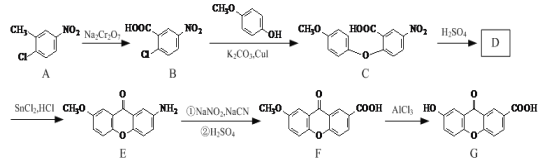
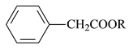 (—R为烃基)。
(—R为烃基)。 和CH3OH为原料制备
和CH3OH为原料制备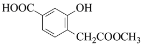 ,写出合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:_________________________
,写出合成路线流程图(无机试剂可任选)。合成路线流程图示例如下:_________________________