-
将40 g氢氧化钠溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为( )
A. 0.1 mol·L-1 B. 0.5 mol·L-1 C. 4 mol·L-1 D. 1 mol·L-1
难度: 简单查看答案及解析
-
下列实验操作中错误的是( )
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B. 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
C. 蒸发结晶时应将溶液蒸干
D. 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘中
难度: 中等查看答案及解析
-
某10%的 NaOH溶液,加热蒸发掉100g水后(无晶体析出)得到80mL 20%的NaOH溶液,则该20%的 NaOH溶液的溶质的物质的量浓度为( )
A. 6.25mol·L-1 B. 12.5mol·L-1 C. 7mol·L-1 D. 7.5mol·L-1
难度: 简单查看答案及解析
-
在盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的( )

难度: 简单查看答案及解析
-
下列有关仪器的使用正确的是
A. 手持试管给试管内的物质加热
B. 用燃着的酒精灯去点燃另一盏酒精灯
C. 用天平称量药品时用手直接拿砝码
D. 用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁
难度: 简单查看答案及解析
-
下列实验中均需要的仪器是
①配制一定物质的量浓度的溶液 ②蒸发 ③过滤
A. 试管 B. 胶头滴管 C. 玻璃棒 D. 漏斗
难度: 简单查看答案及解析
-
某同学在实验报告中记录下列数据,其中正确的是
A. 用100mL量筒量取8mL盐酸 B. 用托盘天平称量8.75g食盐
C. 用500mL的容量瓶配制498mL溶液 D. 用分析天平称量8.7g食盐
难度: 简单查看答案及解析
-
在下列操作中,一般情况下不能相互接触的是
A. 过滤时,玻璃棒与三层滤纸
B. 分液时,分液漏斗下端与烧杯内壁
C. 过滤时,烧杯内壁与漏斗下端
D. 用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁
难度: 简单查看答案及解析
-
关于粗盐提纯的下列说法中正确的是
A. 溶解粗盐时,应无限的多加水,防止食盐不完全溶解
B. 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C. 当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D. 将制得晶体转移到新制过滤器中用大量水进行洗涤
难度: 简单查看答案及解析
-
关于容量瓶的四种叙述:①是配制一定物质的量浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是
A. ①②③④ B. ②③ C. ①②④ D. ②③④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 64 g SO2含有氧原子数为NA
B. 物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为 NA
C. 标准状况下,22.4 L H2O的分子数为NA
D. 常温常压下,14 g N2含有分子数为0.5 NA
难度: 简单查看答案及解析
-
若某原子的摩尔质量是M g·mol-1,则一个该原子的真实质量是
A. M g B.
g C.
g D.
g
难度: 中等查看答案及解析
-
下列说法中不正确的是
A. 1 mol O2中含有1.204×1024个氧原子,在标准状况下的体积为22.4 L
B. 1 mol臭氧和1.5 mol氧气含有相同的氧原子数
C. 等物质的量的CO2和C6H12O6所含碳原子数之比为1∶6,氧原子数之比为1∶3
D. 等体积、浓度均为1 mol/L的硫酸和盐酸,电离出的氢离子数之比为1∶1
难度: 中等查看答案及解析
-
下列溶液中,物质的量浓度最大的是
A. 1 L 硫酸溶液中含98 g H2SO4 B. 0.5 L含49 g H2SO4的溶液
C. 98 g H2SO4溶于水配成2 L溶液 D. 0.1 L含24.5 g H2SO4的溶液
难度: 简单查看答案及解析
-
下列物质中,摩尔质量最大的是
A. 10 mL H2O B. 0.8 mol H2SO4 C. 54 g Al D. 1 g CaCO3
难度: 简单查看答案及解析
-
在标准状况下,相同质量的下列气体:①Cl2 ②H2 ③N2 ④CO2 ⑤O2,占有体积由大到小的顺序是
A. ③②④⑤① B. ③②④①⑤ C. ①④⑤②③ D. ②③⑤④①
难度: 简单查看答案及解析
-
所含分子数相同的一组物质是:( )
A.1g H2和1g N2 B. 1mol H2O和1g H2O
C.3.2g O2和2.24L的空气(标准状况下) D. 44gCO2和6.02×1022个O2
难度: 中等查看答案及解析
-
下列叙述正确的是
A. H2SO4 的摩尔质量为98 B. 1 mol H2SO4 的质量是98g/mol
C. 0.5mol的氧 D. 6.02×1022个 H2SO4 分子的质量为9.8g
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列叙述不正确的是()
A. 等物质的量的N2和CO所含分子数均为NA
B. 1.7 g H2O2中含有电子数为0.9 NA
C. 常温下,1 L 0.1mol/L 的NH4NO3溶液中含氮原子数为0.2 NA
D. 盛有SO2的密闭容器中含有 NA个氧原子,则SO2的物质的量为0.5 mol
难度: 中等查看答案及解析
-
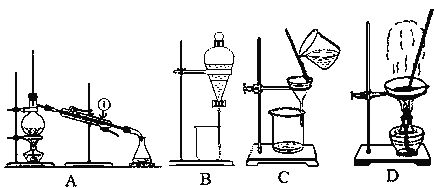
化学是以实验为基础的科学,关于下列各实验装置的叙述中,正确的是( )
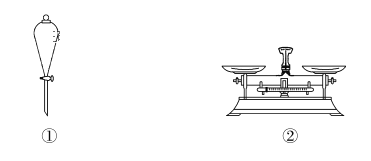
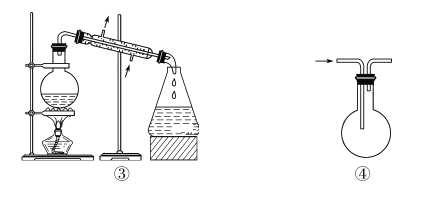
A. 仪器①可用于乙醇与水分离提纯 B. 仪器②可用于称取5.85 g氯化钠固体
C. 装置③的烧瓶中应加沸石,以防暴沸 D. 装置④从箭头方向进气,用排空气法可收集H2
难度: 中等查看答案及解析
-
某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图所示。烧杯的实际质量为

A. 32.6 g B. 27.6g C. 32.3g D. 27.4g
难度: 中等查看答案及解析
-
在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g·cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为
A. 18.4mol·L-1 34.7% B. 20.4mol·L-1 38.5%
C. 18.4mol·L-1 38.5% D. 20.4mol·L-1 34.7%
难度: 简单查看答案及解析
-
由H2、NO和O2组成的混合气体在同温同压下与C2H6的密度相同,则该混合气体中H2、NO和O2的体积之比为
A. 1:1:1 B. 2:1:13 C. 1:16:14 D. 13:1:2
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 标准状况下,22.4 L 的CCl4 中含有的分子数为NA
B. 分子总数为NA的NO2和CO2的混合气体中含有的氧原子数为2 NA
C. 欲配制1.00 mol/L的NaCl 溶液,可将58.5 gNaCl溶于1.00L水中
D. 1 mol Al3+含有的核外电子数为13NA
难度: 中等查看答案及解析
-
下列溶液中Cl—浓度由大到小的顺序是
①200 mL 2 mol/L MgCl2溶液 ②1000 mL 2.5mol/L NaCl溶液 ③250 mL 1 mol/L FeCl3溶液
A. ②①③ B. ③①② C. ①③② D. ①②③
难度: 简单查看答案及解析
-
下列关于物质的量浓度表述正确的是
A. 0.3 mol/L 的Na2SO4溶液中含有Na+和SO42—的总物质的量为0.9 mol
B. 当1 L水吸收22.4 L 氨气时所得氨水的浓度是1 mol/L
C. K2SO4和NaCl的混合溶液中,如果Na+和SO42—的物质的量相等,则K+和Cl—的物质的量浓度一定相等
D. 10℃时,0.35 mol/L的KCl饱和溶液100 mL蒸发掉5 g 水,冷却至原温度,其体积小于100 ml,它的物质的量浓度仍为0.35 mol/L
难度: 简单查看答案及解析
-
标准状况下有①6.72 L CH4 ②3.01×1023个HCl ③13.6 g H2S ④0.2 mol NH3,下列对四种气体的关系表示不正确的是
A. 体积④<①<③<②
B. 密度①<④<③<②
C. 质量④<①<③<②
D. 氢原子数④<②<③<①
难度: 困难查看答案及解析
-
只给出下列甲中和乙中对应的量,不能组成一个求物质的量浓度公式的是
序号
①
②
③
④
⑤
甲
物质微粒数
标准状况下气体摩尔体积
溶质Na2SO4的质量
溶质KCl的质量分数
非标准状况下物质的质量
乙
阿伏加德罗常数
标准状况下气体密度
溶液的体积
溶液的密度
物质的摩尔质量
A. ①②⑤ B. ①②④⑤ C. ③④ D. ③
难度: 中等查看答案及解析
-
标准状况下,将V LA气体(摩尔质量为M g/mol)溶于0.1 L水中,所得溶液密度为ρ g/mL,则此溶液物质的量浓度为( )
A.
mol/L B.
mol/L
C.
mol/L D.
mol/L
难度: 简单查看答案及解析