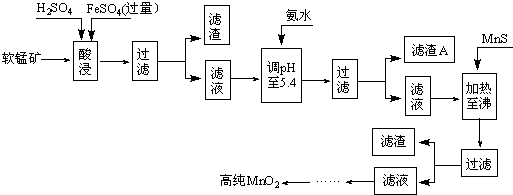
-
将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离子积变大、pH变小、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积不变、pH不变、呈中性难度: 中等查看答案及解析
-
控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如右图所示的原电池.下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极难度: 中等查看答案及解析
-
下列液体中pH>7的是( )
A.人体血液
B.蔗糖溶液
C.橙汁
D.胃液难度: 中等查看答案及解析
-
下列事实可证明氨水是弱碱的是( )
A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁
B.铵盐受热易分解
C.0.1mol•L-1氨水可以使酚酞试液变红
D.0.1mol•L-1氯化铵溶液的pH约为5难度: 中等查看答案及解析
-
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH(s)
B.CH3COONa(s)
C.NH4Cl(s)
D.NaHSO4溶液难度: 中等查看答案及解析
-
酸和碱恰好中和时,它们起反应的( )一定相等.
A.体积
B.物质的量
C.H+和OH-的物质的量
D.物质的量浓度难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.在AgCl悬浊液中加入KI溶液充分振荡Ag++I-=AgI↓
B.HS-的水解方程式:HS-+H2OH2S+OH-
C.NaHCO3在水溶液中的电离方程式:NaHCO3Na++HCO3-
D.氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH-难度: 中等查看答案及解析
-
将0.1mol•L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液的pH增大
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液中c(H+)和c(OH-)都减小难度: 中等查看答案及解析
-
如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液.(该过程中不考虑两球浮力的变化)下列说法正确的是( )

A.若杠杆由绝缘体材料制成,一段时间后,杠杆一定B端高A端低
B.若杠杆由导体材料制成,一段时间后,杠杆一定B端高A端低
C.若杠杆由导体材料制成,一段时间后,杠杆一定A端高B端低
D.杠杆一定A端高B端低,与其材质无关难度: 中等查看答案及解析
-
一元强酸X和一元弱酸Y,pH值均等于2,各取1L与足量的Mg反应,下列叙述正确的是( )
A.X产生的H2多
B.反应开始瞬间X反应速度快
C.两者产生的H2一样多
D.反应开始瞬间两者速度相等难度: 中等查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中不正确的是( )
A.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3-)>c(OH-)>c(H+)
B.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3-)>c(OH-)
C.HN3与NH3作用生成的叠氮酸铵是弱电解质
D.叠氮酸是共价化合物难度: 中等查看答案及解析
-
蒸干并灼烧下列物质的水溶液,仍能得到该物质的是( )
A.氯化铝
B.碳酸钠
C.硫酸亚铁
D.碳酸氢钠难度: 中等查看答案及解析
-
为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,这种试剂是( )
A.NH3•H2O
B.NaOH
C.Na2CO3
D.MgCO3难度: 中等查看答案及解析
-
在指定环境中,下列各组离子可以大量共存的是( )
A.无色溶液中:Cu2+、K+、H+、NO3-
B.滴加酚酞试液呈无色的溶液中:CO32-、K+、Na+、AlO2-
C.在c(H+)/c(OH-)=1×1012的溶液中:NH4+、Ca2+、Cl-、K+
D.pH=13的溶液中:Na+、NH4+、HCO3-、NO3-难度: 中等查看答案及解析
-
用物质的量都是0.1mol的CH3COOH和CH3COONa配制成1L混合溶液,已知其中c(CH3COO-)>c(Na+),对该混合溶液的下列判断正确的是( )
A.c(H+)>C(OH-)
B.c(CH3COOH)+c(CH3COO-)=0.1mol•L-1
C.c(CH3COOH)>c(CH3COO-)
D.c(CH3COO-)+c(OH-)=0.2mol•L-1难度: 中等查看答案及解析
-
下列关系的表述中,正确的是( )
A.0.1mol•L-1NaHSO4溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-)
B.中和pH和体积都相同的盐酸和醋酸,消耗NaOH的物质的量之比为1:1
C.pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)不相等
D.0.1mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)难度: 中等查看答案及解析
-
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,其中错误的是( )
A.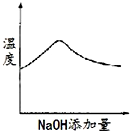
B.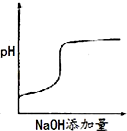
C.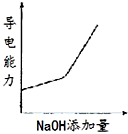
D.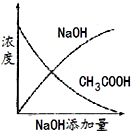
难度: 中等查看答案及解析
-
下列各组比值中,等于1:3的是( )
①硝酸铁溶液中,c(Fe3+):c(NO3-)②pH=1的盐酸跟pH=3的盐酸的物质的量浓度之比 ③0.1mol/L醋酸跟0.3mol/L醋酸溶液中氢离子浓度之比 ④0.1mol/L的醋酸钠跟0.3mol/L的氯化钠溶液中的Na+离子浓度之比.
A.①②
B.①②③
C.③④
D.只有④难度: 中等查看答案及解析
-
常温下,物质的量浓度相同、体积也相同的下列各组物质混合后能使pH大于7的是( )
A.NaHCO3、HCl、KCl
B.NaHSO4、H2SO4、NaCl
C.K2S、KCl、HCl
D.K2CO3、HCl、NaHSO4难度: 中等查看答案及解析
-
一种一元强酸HA溶液中加入一种MOH反应后,溶液呈中性,下列判断正确的是( )
A.加入的碱过量
B.混合前酸与碱中溶质的物质的量相等
C.生成的盐不发生水解
D.反应后溶液中的A-、M+物质的量浓度相等难度: 中等查看答案及解析