-
我国科技创新成果斐然,下列成果中以制备非金属单质为主要目的的是( )


A.成功开采可燃冰(CH4•nH2O)
B.研制出超高强钢
C.合成全氮阴离子盐
(N5)6(H3O)3(NH4)4Cl
D.低温制备H2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生活、环境密切相关,下列有关说法不正确的是( )
A. Na2O2 吸收 CO2 产生 O2,可用作呼吸面具供氧剂
B. 竹炭具有超强的吸附能力,可用于吸收新装修房屋内的有害气体
C. 碘酸钾具有较强氧化性,在食盐中加入适量碘酸钾,可抗人体老化
D. 研发使用高效电力能源汽车,减少雾霾污染以降低呼吸系统发病率
难度: 中等查看答案及解析
-
下列各组物质的分类或变化正确的是( )
①混合物:氯水、氨水、水玻璃、水银、食醋、淀粉 ②含有氧元素的化合物叫氧化物 ③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2 为碱性氧化物 ④同素异形体:C60、C70、金刚石、石墨 ⑤在熔融状态下能导电的化合物为离子化合物 ⑥强电解质溶液的导电能力一定强 ⑦有单质参加的反应或有单质产生的反应是氧化还原反应 ⑧煤的气化、液化、干馏都是化学变化
A. ④⑤⑧ B. ②③⑤ C. ①④⑥⑦ D. ③④⑦⑧
难度: 中等查看答案及解析
-
关于胶体的性质与应用,相关说法错误的是
A. 明矾净水是利用胶体的吸附性
B. 胶体区别于其他分散系的本质特征是有丁达尔效应
C. 胶粒不能透过半透膜,血液透析利用半透膜将有害物质移出体外
D. 静电除尘器除去空气或工厂废气中的飘尘,是利用胶体粒子的带电性而加以除去
难度: 中等查看答案及解析
-
《淮南万毕术》中有“曾青得铁,则化为铜,外化而内不化”,下列说法中正确的是( )
A. “化为铜”表明发生了氧化还原反应 B. “外化”时化学能转化为电能
C. “内不化”是因为内部的铁活泼性较差 D. 反应中溶液由蓝色转化为黄色
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A. 无色溶液中:Na+、NH4+、Cu2+、SO42—
B. 0.1mol·L—1的 NH4HCO3溶液中:K+、SiO32—、AlO2—、Cl—
C. KW/c(H+)=1×10mol·L—1的溶液中:K+、NO3—、S2—、ClO—
D. 使甲基橙呈红色的溶液:NH4+、Ba2+、Al3+、Cl—
难度: 中等查看答案及解析
-
下列反应对应的离子方程式书写正确的是( )
A. Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH -+O2↑
B. 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO—+SO2+H2O=CaSO3↓+2HClO
C. 饱和碳酸钠溶液中通入足量的二氧化碳:2Na++CO32—+CO2+H2O=2NaHCO3↓
D. Ca(HCO3)2溶液与少量NaOH 溶液反应:2HCO3—+Ca2++2OH—=CaCO3↓+CO32—+2H2O
难度: 中等查看答案及解析
-
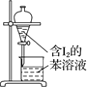
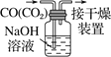
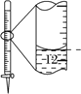
下列有关实验的选项正确的是
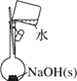
A.配制 0.10 mol·L-1NaOH溶液
B.苯萃取碘水中I2,分出水层后的操作
C.除去CO中的CO2
D.记录滴定终点读数为12.20mL
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 标准状况下,2.24L 四氯化碳含有的分子数目为 0.1NA
B. 25℃时,0.1 mol·L-1Na2S溶液中含有Na+的数目为0.2NA
C. 64g的SO2与足量的O2充分反应后可得到NA个SO3分子
D. 2.3gNa与O2完全反应生成3.6g产物时失去的电子数为0.1NA
难度: 中等查看答案及解析
-
某溶液中含有的溶质是 FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,则下列叙述正确的是( )
A. 原溶液中的Br—一定被氧化
B. 不能确定通入氯气之后的溶液中是否存在Fe2+
C. 通入氯气之后,原溶液中的Fe2+不一定被氧化
D. 若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,一定能产生淡黄色沉淀
难度: 困难查看答案及解析
-
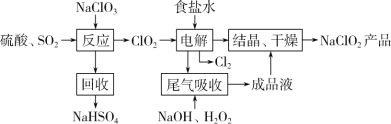
MnO2 和 Zn 是制造普通干电池的重要原料,现用软锰矿(主要成分为 MnO2)和闪锌矿(主要成分为 ZnS)制备MnO2和Zn的工艺流程如下:
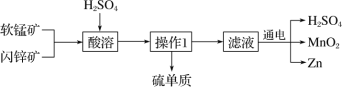
下列说法不正确的是( )
A. 酸溶时,ZnS 作还原剂 B. 原料硫酸可以循环使用
C. 操作 1 是萃取 D. 不可用盐酸代替硫酸进行酸溶
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
选项
实验
操作
A
观察Na 与H2O 反应的现象
用镊子从煤油中取出金属钠,用滤纸吸去表面煤油,
切下绿豆大小的钠,小心放入装有水的试管中
B
证明Na2O2 与 CO2 是放热反应
Na2O2 用棉花包裹,放入充满 CO2 的集气瓶中,棉
花燃烧说明是放热反应
C
检验NaHCO3 与Na2CO3 溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
D
检验Na2CO3 与 K2CO3 溶液
用铂丝分别蘸取溶液,在酒精灯外焰上灼烧,直接
观察火焰的颜色
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC12•2H2O 制备 CuCl,并进行相关探究。下列说法正确的是( )
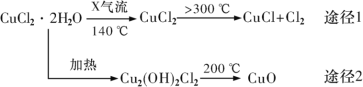
A. 途径 1 中产生的Cl2 可以回收循环利用,也可以通入饱和CaCl2 溶液中除去
B. 途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2
2CuO+2HCl↑
C. X 气体可以是N2,目的是做保护气,抑制 CuCl2•2H2O 加热过程可能的水解
D. CuCl 与稀硫酸反应的离子方程式为:2CuCl+4H++SO42—=2Cu2++2Cl—+SO2↑+2H2O
难度: 困难查看答案及解析
-
向CuSO4 溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列有关分析中正确的是( )
A. 滴加KI溶液时,每转移 2mole—会生成 2mol CuI 沉淀
B. 在 SO2 与 I2 反应中得到的还原产物为 H2SO4
C. 通入SO2 后溶液逐渐变成无色,体现了SO2的漂白性
D. 上述实验条件下,物质的氧化性:Cu2+>SO2>I2
难度: 困难查看答案及解析
-
某同学用下图所示装置检验草酸亚铁晶体(FeC2O4•2H2O,淡黄色)受热分解的部分产物。下列说法正确的 是( )
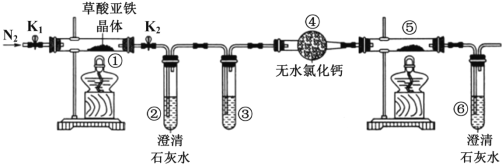
A. 通入N2 的主要目的是防止空气中的水蒸气对产物检验产生影响
B. 若将④中的无水 CaC12 换成无水硫酸铜可检验分解生成的水蒸气
C. 若检验有 CO 生成,③和⑤中分别盛放足量NaOH 溶液、CuO
D. 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
难度: 中等查看答案及解析
-
将 51.2g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、N2O4、NO2)的混合物共 0.8mol, 这些气体恰好能被 600mL 2 mol·L—1NaOH 溶液完全吸收,生成含 NaNO3 和NaNO2 的盐溶液,其中 NaNO3 的物质的量为( )
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
难度: 中等查看答案及解析