-
某元色溶液中加入铝粉有氢气放出,则在该溶液中可能大量共存的离子组是
A.K+、
、
、OH- B.Fe3+、Ba2+、H+、I-
C.H+、
、Cl-、
D.Na+、Al3+、
、
难度: 中等查看答案及解析
-
下列关于化学键和物质结构的说法中正确的是
A.干冰和水晶熔化时,所克服的作用力相同
B.原子晶体氮化硅制成的陶瓷具有熔点高、硬度大等特点
C.由非金属元素组成的化合物一定是共价化合物
D.不同元素组成的多原子分子里的化学键一定是极性键
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法中不正确的是
A.20 gD2O中含有的中子数为10NA
B.3 g甲醛中含有的共价键数为0.4NA
C.14 g乙烯和丙烯的混合物中含有的原子总数为2NA
D.含NA个阳离子的CaC2固体投入足量水中,产生的乙炔为22.4L(标准状况)
难度: 中等查看答案及解析
-
关于元素周期表和元素周期律的说法中正确的是
A.第ⅠA族元素的金属性一定比第ⅡA族的强
B.F-、Na+、Mg2+、Al3+的离子半径依次增大
C.第ⅥA族元素的氢化物中,稳定性最强的其沸点最低
D.按照元素周期表的排布规律,非金属元素最多为23种
难度: 中等查看答案及解析
-
达菲是治疗甲型H1N1流感的有效药物之一。合成达菲的原料是莽草酸,已知莽草酸和达菲的结构简式如下图所示,则有关说法中不正确的是
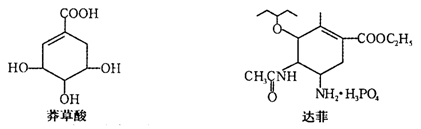
A.1 mol莽草酸与足量金属钠反应最多可生成2 mol氢气
B.达菲既可催化加氢,又可使酸性KMnO4溶液褪色
C.达菲既可发生水解反应,又可与Br2的CCl4溶液发生加成反应
D.莽草酸既可与FeCl3溶液发生显色反应,又可与NaHCO3溶液反应放出CO2
难度: 中等查看答案及解析
-
常温下,在10 mL 0.2 mol/L某一元强酸HA的溶液中逐滴加入a mL 0.1 mol/L的氨水,下列有关说法中正确的是
A.当c(
)=c(A-)时,a一定等于20
B.当c(
)>c(A-)时,a一定大于20
C.当c(H+)>c(OH-)时,a一定小于20
D.当pH=7时,c(
)=c(A-)=c(H+)=c(OH-)
难度: 中等查看答案及解析
-
300℃时,将100 mL由H2O、CO2和N2组成的混合气体,通入到盛有足量Na2O2的密闭容器中(容器体积保持不变),充分反应后恢复到原温度时,容器内的压强变为原来的四分之三。则原混合气体中N2的体积分数为
A.33.3% B.25% C.50% D.75%
难度: 中等查看答案及解析
-
已知:H2(g)+I2(g)
2HI(g),△H<0,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图正确的是

难度: 中等查看答案及解析



 。
。