-
已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为CuSO4·5H2O(s)==CuSO4(s)+5H2O(l) ΔH=+Q1 kJ·mol-1,室温下,若将1 mol无水硫酸铜溶解为溶液时放热Q2 kJ,则( )
A. Q1=Q2 B. Q1>Q2 C. Q1<Q2 D. 无法比较
难度: 困难查看答案及解析
-
下列说法中正确的是( )
A. CH4和BCl3分子中所有原子的最外层都达到了8电子稳定结构
B. Na2O2、NaClO中所含化学键类型不完全相同
C. Si与C同属ⅣA族,因此SiO2和CO2两种物质中微粒间作用完全相同
D. 氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A. Fe3O4 溶于足量氢碘酸:Fe3O4+8H+= Fe2++2Fe3+ +4H2O
B. 过氧化钠投入水中发生:2Na2O2+2H2O=4OH-+4Na+ +O2↑
C. 向100ml 0.5mol/L NaOH溶液中通入足量 CO2 (标准状况):CO2 +2OH‾=CO32—+2H2O
D. 向含1mol FeBr2的溶液中通入少量Cl2:2Br—+Cl2 =Br2+2Cl—
难度: 中等查看答案及解析
-
利用右图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
A
稀硫酸
Na2SO3
Na2SiO3溶
非金属性:S>Si
B
浓硫酸
蔗糖
溴水
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是( )
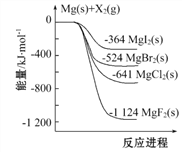
A. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方 程式为:MgBr2(s)+Cl2(g)
MgCl2(s)+Br2(g) ΔH=+117 kJ·mol-1
B. 热稳定性: MgI2 > MgBr2 > MgCl2 > MgF2
C. 工业上可由电解MgCl2溶液冶炼金属Mg,该过程需吸收热量
D. 金属镁和卤素单质(X2)的反应能自发进行是因为ΔH均小于零
难度: 困难查看答案及解析
-
2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
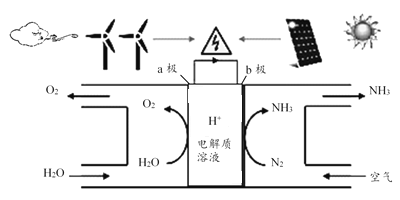
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
难度: 困难查看答案及解析
-
有Ⅰ、Ⅱ、Ⅲ3个体积均为0.5 L的恒容密闭容器,在Ⅰ、Ⅱ、Ⅲ中按不同投料比(Z)充入HCl和O2(如下表),加入催化剂发生反应:4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) △H。HCl的平衡转化率与Z和T的关系如图所示。
容器
起始时
T/℃
n(HCl)/mol
Z
Ⅰ
300
0.25
a
Ⅱ
300
0.25
b
Ⅲ
300
0.25
4
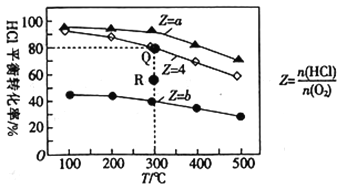
下列说法不正确的是( )
A. △H<0
B. a<4<b
C. 若容器Ⅲ反应某时刻处于R点,则R点的反应速率:v(正)>v(逆)
D. 300 ℃时,该反应平衡常数的值为320
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 用盐酸标准溶液测定NaOH溶液浓度滴定实验中,滴定前无气泡而滴定后有气泡,会使测定值偏高
B. 将地下钢管与直流电源的正极相连,用来保护钢管
C. 已知在101KPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为:2H2(g)+O2(g)=2H2O(g) △H=-484 kJ·mol-1
D. 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ·mol-1,表示稀H2SO4与KOH 溶液反应的中和热的热化学方程式为:H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l)△H=-114.6kJ·mol-1
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
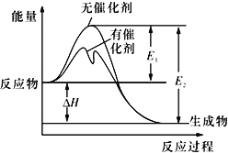
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
难度: 困难查看答案及解析
-
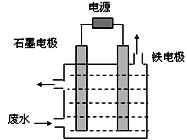
用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:

下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
难度: 困难查看答案及解析
-
在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
难度: 困难查看答案及解析
-
已知液氨的性质与水相似。T ℃时,NH3+NH3 ⇌ NH4 ++NH2 - ,NH4 +的平衡浓度为 1×10-15 mol/L,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为 1×10-17
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入 NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且 c(NH4 +)<c(NH2 - )
难度: 困难查看答案及解析
-
如图所示,左室容积为右室的两倍,温度相同,现分别按照如图所示的量充入气体,同时加入少量固体催化剂使两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列说法不正确的是
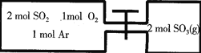
A. 第一次平衡时,SO2的物质的量左室更多
B. 通入气体未反应前,左室压强和右室一样大
C. 第一次平衡时,左室内压强一定小于右室
D. 第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍还要多
难度: 困难查看答案及解析
-
工业碳酸钠(纯度约为98%)中含有Mg2+、Fe2+、Cl-和SO42-等杂质,提纯工艺流程如下:
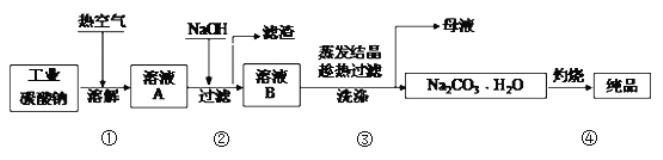
下列说法不正确的是
A. 步骤①,通入热空气可加快溶解速率
B. 步骤②,产生滤渣的离子反应为:Mg2+ + Fe3+ + 5OH- == Mg(OH)2↓+ Fe(OH)3↓
C. 步骤③,趁热过滤时温度控制不当会使Na2CO3•H2O中混有Na2CO3•10H2O等杂质
D. 步骤④,灼烧时用到的主要仪器有铁坩埚、泥三角、三脚架、酒精灯
难度: 困难查看答案及解析
-
全钒液流电池工作原理如图所示。在电解质溶液中发生的电池总反应为:VO2+(蓝色)+H2O+V3+(紫色)
VO2+(黄色)+V2+(绿色)+2H+。下列说法正确的是( )
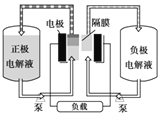
A. 当电池无法放电时,只要更换电解质溶液,不用外接电源进行充电就可正常工作
B. 放电时,负极反应为VO2++2H++e-=VO2++H2O
C. 放电时,正极附近溶液由紫色变绿色
D. 放电过程中,正极附近溶液的pH变小
难度: 困难查看答案及解析
-
验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
①
②
③
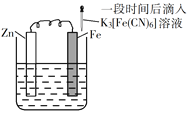
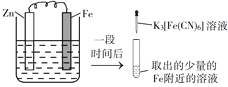
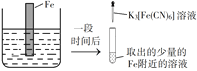
在Fe表面生成蓝色沉淀
试管内无明显变化
试管内生成蓝色沉淀
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
难度: 困难查看答案及解析
-
以NaBH4和H2O2作原料的燃料电池,可用作空军通信卫星。电池负极材料采用Pt/C,正极材料采用MnO2,其工作原理如下图所示。下列说法错误的是
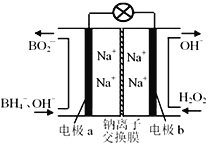
A. 电池放电时Na+从a极区移向b极区
B. 电极b采用Pt/C,该极溶液的pH增大
C. 该电池a极的反应为BH4-+8OH--8e-===BO2-+6H2O
D. 电池总反应:BH4- + 4H2O2 === BO2- + 6H2O
难度: 困难查看答案及解析
-
已知常温时 HClO 的 Ka=3.0×10-8,HF 的 Ka= 3.5×10-4。现将 pH 和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH 随溶液体积的变化如图所示。下列叙述正确的是
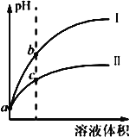
A. 曲线 I 为次氯酸稀释时 pH 变化曲线
B. 取 a 点的两种酸溶液,中和相同体积、相同浓度的NaOH 溶液,消耗次氯酸的体积较小
C. a 点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b 点溶液中水的电离程度比 c 点溶液中水的电离程度小
难度: 困难查看答案及解析
-
常温下,将pH均为3,体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随1g
的变化如右图所示。下列说法正确的是
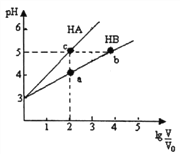
A. 稀释相同倍数时:c(Aˉ)>c(Bˉ-)
B. 水的电离程度:b=c>a
C. 溶液中离子总物质的量:b>c>a
D. 溶液中离子总浓度:a>b>c
难度: 困难查看答案及解析
-
25℃时, c mol·L—1CH3COOH 溶液加水稀释, 溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法不正确的是
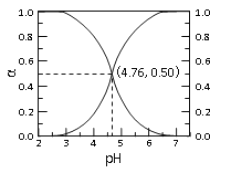
A. 由图可知, 25℃时醋酸的 Ka=10-4.76
B. c mol·L—1CH3COOH 溶液加水稀释中, α(CH3COOH)增大, c(CH3COOˉ)也一定增大
C. 在 pH=4.76 的溶液中通入 HCl, α(CH3COOH)增大,α(CH3COOˉ)减小, α(CH3COOH)+α(CH3COOˉ)=1
D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)
难度: 困难查看答案及解析
 。
。