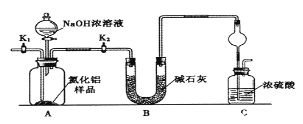
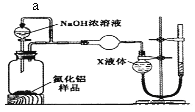
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子
D. 还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A. 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O
B. Mg(HCO3)2 溶液中加入足量 NaOH 溶液:Mg2++2HCO3-+2OH-=MgCO3↓+CO32-+2H2O
C. 向含有 0.2 mol FeI2 的溶液中通入 0.1 mol Cl2 充分反应:2I-+Cl2=2Cl-+I2
D. 明矾溶液中加入 Ba(OH)2 溶液至生成沉淀的物质的量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
难度: 中等查看答案及解析
-
化学中常借助于图像这一表现手段以清晰地突出实验装置的要点,形象地阐述化学过程的原理。 下列有关化学图像表现的内容正确的是

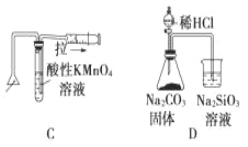
A. 测定一定时间内生成 H2 的反应速率 B. 提取海带中的碘
C. 检验火柴燃烧产生的 SO2 D. 证明非金属性:Cl>C>Si
难度: 中等查看答案及解析
-
设 NA 为阿伏加德罗常数的值,下列有关反应 3Cl2 + 8NH3=6NH4Cl + N2 的说法中正确的是
A. 若有 0.3 mol Cl2 参加反应,则转移的电子数为 0.6NA
B. 若生成 2.24 L N2,则转移的电子数为 0.6NA
C. 若有 1.2NA 个电子发生转移,则被氧化的 NH3 的质量是 27.2 g
D. 若生成 1 mol NH4Cl 转移的电子数是 n,则 NA=1/n
难度: 中等查看答案及解析
-
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)
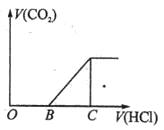
A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
难度: 中等查看答案及解析
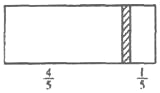
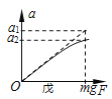
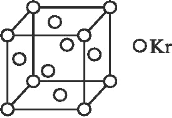
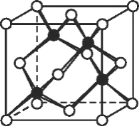
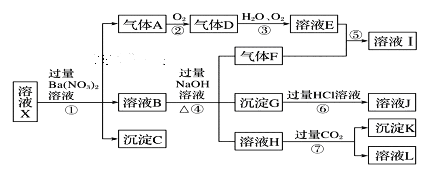
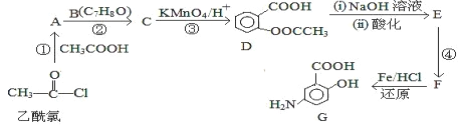

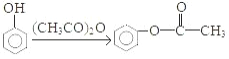
 的流程图(无机试剂任 选)。合成路线流程图示例如下:X
的流程图(无机试剂任 选)。合成路线流程图示例如下:X