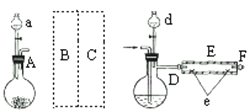
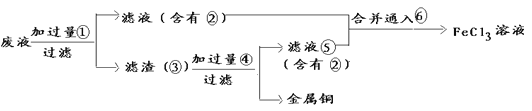
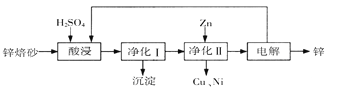
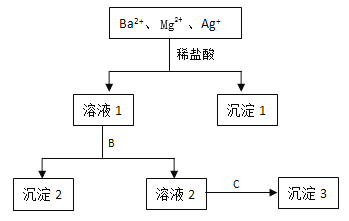
-
下列化工生产过程中,未涉及氧化还原反应的是( )
A. 海带提碘 B. 氯碱工业
C. 氨碱法制碱 D. 海水提溴
难度: 中等查看答案及解析
-
用石灰水保存鲜蛋是一种化学保鲜法。石灰水能保存鲜蛋的原理是
①石灰具有强碱性,杀菌能力强;
②Ca(OH)2能与鲜蛋呼出的CO2反应,生成碳酸钙薄膜,起保护作用;
③石灰水是电解质溶液,能使蛋白质凝聚;
④石灰水能渗入蛋内中和酸性物质。
A. ①② B. ③④ C. ②④ D. ①③
难度: 简单查看答案及解析
-
下列物质的分类正确的是
碱
酸
盐
酸性氧化物
混合物
A.
NaOH
H2SO4
BaCO3
CO2
硫酸
B.
KOH
HCl
NaCl
CO
豆浆
C.
Mg(OH)2
CH3COOH
CaCl2
SO2
盐酸
D.
纯碱
HNO3
CaCO3
SO3
空气
难度: 中等查看答案及解析
-
生产生活中的许多现象或应用都与化学知识有关。下列现象或应用与胶体性质无关的是
A. 将盐卤或石膏加入豆浆,制成豆腐。
B. 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞。
C. 泡沫灭火器中将Al2(SO4)3与NaHCO3两溶液混合后,喷出大量泡沫,起到灭火作用。
D. 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象。
难度: 简单查看答案及解析
-
下列物质属于电解质的是( )
A.氯气 B.氯化氢 C.蔗糖 D.Na2SO4溶液
难度: 简单查看答案及解析
-
下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A. 盐酸、水煤气、醋酸、干冰 B. 冰醋酸、福尔马林、硫酸钠、乙醇
C. 单甘油酯、混甘油酯、苛性钾、石灰石 D. 胆矾、漂白粉、氯化钾、氯气
难度: 中等查看答案及解析
-
在0℃和101kPa的条件下,将2.00g氮气、1.40g氮气和1.60g氧气混合,该混合气体的体积是
A. 6.72L B. 7.84L C. 10.08L D. 13.44L
难度: 困难查看答案及解析
-
下列离子方程式表达正确的是
A. 用惰性电极电解氯化镁溶液:2Cl-+2H2O
Cl2↑+H2↑+OH-
B. 碳酸氢钠溶液与过量澄清石灰反应:HCO3-+Ca2++OH-= CaCO3↓+ H2O
C. NaHS04溶液中滴入Ba(OH)2溶液至S042-完全沉淀:2H++S042-+Ba2++ OH-= BaS04↓+2 H2O
D. 向明矾溶液中滴加过量氨水:Al3++4NH3
H2O=Al02-+4NH4++2H2O
难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A. 在硫酸氢钾溶液中加入氢氧化钡溶液至中性:Ba2++OH-+H++SO42-===BaSO4↓+H2O
B. 澄清石灰水与少量小苏打溶液混合:HCO3-+Ca2++OH-===CaCO3↓+H2O
C. 少量金属钠加到冷水中:Na+2H2O===Na++2OH-+H2↑
D. 明矾水【解析】
Al3++3H2O===Al(OH)3↓+3H+难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.明矾、小苏打、醋酸、次氯酸均为电解质
B.碘酒、牛奶、豆浆、漂白精均为胶体
C.根据是否具有丁达尔现象可将分散系分为溶液、胶体和浊液
D.物质可根据在水中或熔化状态下的导电性分为电解质与非电解质
难度: 中等查看答案及解析