-
化学与科技、医药、工业生产均密切相关。下列有关叙述正确的是:( )
A. 2017年4月26日,中国第二艘航母举行下水仪式,该航母使用了素有“现代工业的骨骼”之称的碳纤维。碳纤维是一种新型的有机高分子材料
B. 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜
C. 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的主要材料是经提纯的SiO2
D. 获得2015年诺贝尔生理学、医学奖的屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理
难度: 中等查看答案及解析
-
下列叙述正确的有 ( )
①碱性氧化物:Na2O2、MgO、Al2O3
②Ca(HCO3)2、Fe(OH)3、FeCl2均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为:溶液、胶体
④灼热的炭与CO2反应、Ba(OH)2·8H2O与NH4Cl反应均既是氧化还原反应,又是吸热反应
⑤碱石灰、生石灰、玻璃、漂白粉、光导纤维都是混合物
⑥苛性钠、次氯酸、氯气按顺序分类依次为:强电解质、弱电解质和非电解质
A. 1个 B. 2个 C. 3个 D. 4个
难度: 中等查看答案及解析
-
下列物质转化在给定条件下不能实现的是
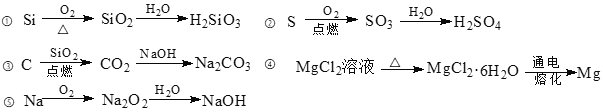
A. ①②③ B. ①②④ C. ①②③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA
B. 18g D2O和18g H2O中含有的质子数均为10NA
C. 标准状况下,22.4L CHCl3中含有氯原子数目为3NA
D. 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA
难度: 中等查看答案及解析
-
饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶,上述过程涉及的实验方法、实验操作和物质作用说法 不正确的是
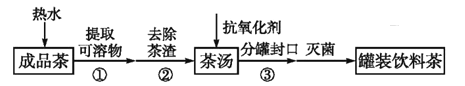
A.
操作利用了物质的溶解性
B.
操作为分液
C.
操作为过滤
D. 加入抗氧化剂是为了延长饮料茶的保质期
难度: 简单查看答案及解析
-
下列离子方程式不正确的是
A. Ca(OH)2溶液与足量Ca(HCO3)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3 ↓+CO32-+2H2O
B. 金属钠和水反应:2Na+2H2O=2Na++2OH-+H2↑
C. 泡沫灭火器工作原理:Al3++3HCO3-=Al(OH)3↓+3CO2↑
D. 二氧化硫与氯化铁溶液反应:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+
难度: 中等查看答案及解析
-
南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
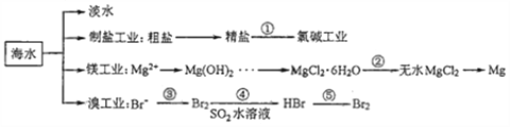
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
难度: 简单查看答案及解析
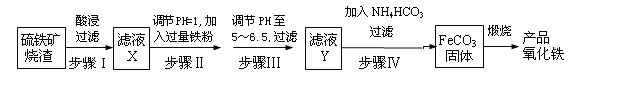
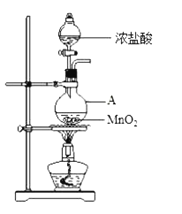
 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
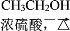 CH3COOCH2CH3______________________
CH3COOCH2CH3______________________