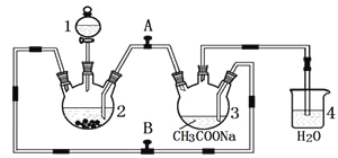
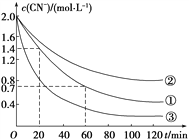
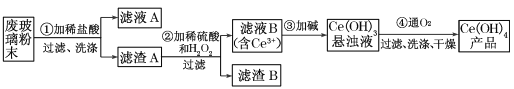
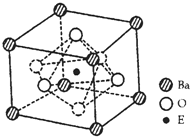
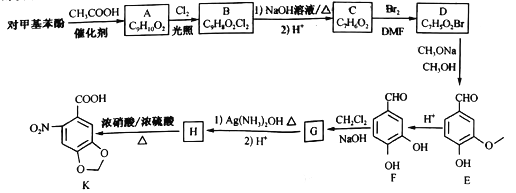
-
下列实验操作和现象所得结论正确的是
选项
操作
现象
结论
A
向等物质的量浓度的NaNO3溶液和Na2SiO3溶液中分别滴加3滴酚酞溶液
NaNO3溶液为无色,Na2SiO3溶液变成红色
非金属性:N>Si
B
将湿润的KI—淀粉试纸置于集满某气体的集气瓶口
试纸变蓝
该气体为Cl2
C
将浓盐酸滴入NaHSO3溶液,所得气体依次通过浓硫酸和CuSO4,收集气体
CuSO4颜色未发生改变
收集到纯净的SO2
D
向含有少量FeCl3的FeCl2溶液中加入铜粉
铜粉有剩余
所得溶液中的溶质只有FeCl2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,11.2L甲醇中含有的分子数为0.5NA
B. 4.4gN2O和CO2的混合气体中含有的原子数为0.3NA
C. 4.2g乙烯和丙烯混合气体中含有的共价键数为0.6NA
D. 25°C时,1.0L , PH = 13 的 Ba(OH)2 溶液中含有的OH-数为0.2NA
难度: 中等查看答案及解析
-
W、X、Y、Z均是短周期元素,X、Y、Z处于同一周期,W、X、Z的简单离子具有相同的电子层结构, W的最高氧化物的水化物可与其最简单的气态氢化物反应生成易溶于水的盐,X的氧化物具有两性,Y的最高正价与最低负价的代数和为0,下列说法正确的是( )
A. 离子半径:W> Z > X B. 单质熔点:W>Z
C. 最高正价:W> X >Y >Z D. W、X、Z最高价氧化物对应的水化物相互之间能发生反应
难度: 中等查看答案及解析
-
由前18号元素组成的中学常见无机物A、B、C、D、E、X存在如图转化关系(部分生成物和反应条件略去)下列推断不正确的是( )
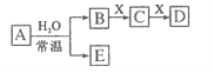
A. 若D为白色沉淀,与A摩尔质量相等,则X一定是含铝元素的盐
B. 若A是单质,B和D的反应是OH-+HCO3-=CO32-+H2O,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为Na2O2,其阳离子与阴离子比为2:1
D. 若X是Na2CO3,C为CO2分子,则A一定是氯气,且D和E不反应
难度: 困难查看答案及解析
-
反兴奋剂是体育赛事关注的热点,利尿酸是一种常见的兴奋剂,其分子结构如图:关于利尿酸的说法中,正确的是( )
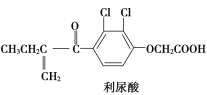
A. 它的分子式是C13H11O4Cl2
B. 它不能使酸性高锰酸钾溶液褪色
C. 它不能与饱和碳酸钠溶液反应放出CO2
D. 它能发生取代反应、加成反应和酯化反应
难度: 中等查看答案及解析
-
部分弱酸的电力平衡常数如下表所示:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
K=1.77×10-4
K=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
下列选项正确的是( )。
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-) < c(K+)-c(CN-)
D. c(NH4+) 相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中,c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
难度: 困难查看答案及解析