-
下列反应既是氧化还原反应,又是吸热反应的是
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
已知:C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol
C(s)+O2(g)=2CO(g) △H=-220 kJ/mol
H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为
A. -332 B. -118 C. +350 D. +130
难度: 困难查看答案及解析
-
下列说法中不正确的是( )
A. 化石燃料在任何条件下都能充分燃烧
B. 化石燃料在燃烧过程中会产生污染环境的CO、 SO2等有害气体
C. 直接燃烧煤不如将煤进行深加工后再燃烧的效果好
D. 固体煤变为气体燃料后,燃烧效率将更高
难度: 中等查看答案及解析
-
用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H=+64.39kJ·mol-1
2H2O2(l)=2H2O(l)+O2(g) △H=-196.46kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H=-285.84kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H2O(l)的反应热△H等于( )
A. -417.91kJ·mol-1 B. -319.68kJ·mol-1
C. +546.69kJ·mol-1 D. -448.46kJ·mol-1
难度: 中等查看答案及解析
-
下列各图是表示相应变化的能量关系图,其中正确的是( )
A. 锌与稀硫酸反应
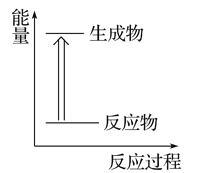 B. 植物的光合作用
B. 植物的光合作用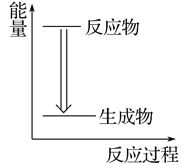 C. 天然气的燃烧
C. 天然气的燃烧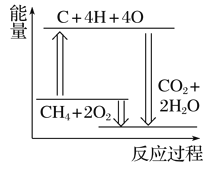 D. 氢气和氯气反应
D. 氢气和氯气反应
难度: 中等查看答案及解析
-
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.
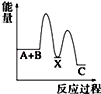 B.
B. 
C.
 D.
D. 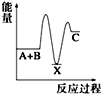
难度: 中等查看答案及解析
-
下图中,表示正反应是吸热反应的是( )
A.
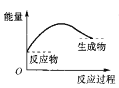 B.
B. 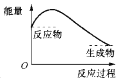 C.
C.  D.
D. 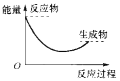
难度: 简单查看答案及解析
-
含有1.2gKOH的稀溶液与1L0.1mol/L的H2SO4溶液反应,放出11.46kJ的热量,表示该反应中和热的化学方程式为( )
A. KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) △H=-11.46kJ·mol-1
B. 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46kJ·mol-
C. 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=+11.46kJ·mol-1
D. KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
难度: 中等查看答案及解析
-
试直接判断下列热化学方程式书写不正确的是( )
A. 1/2H2(g)+1/2Cl2(g)
HCl(g) ΔH=-91.5 kJ/mol
B. 1/2H2(g)+1/2Cl2(g)
HCl(g) ΔH=+91.5 kJ/mol
C. H2(g)+Cl2(g)
2HCl(g) ΔH=-183 kJ/mol
D. 2HCl(g)
H2(g)+Cl2(g) ΔH=+183kJ/mol
难度: 中等查看答案及解析
-
下列热化学方程式中△H表示可燃物燃烧热的是( )
A. CO(g)+1/2O2(g)=CO2(g) △H=-283kJ·mol-1
B. CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-80.2kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
D. H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ/mol
难度: 简单查看答案及解析
-
已知2 mol氢气完全燃烧生成水蒸气时放出能量484 kJ,且氧气中1 mol O===O键完全断裂时吸收能量496 kJ,水蒸气中1 mol H—O键形成时放出能量463 kJ,则氢气中1 mol H—H键断裂时吸收能量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
难度: 中等查看答案及解析
-
在101kPa和25℃时,有关反应的热化学方程式如下:C(s)+1/2O2(g)=CO(g) △H1=-110.5kJ·mol-1
H2(g)+1/2O2(g)=H2O(g) △H2=-241.7kJ·mol-1
H2(g)+1/2O2(g)=H2O(l)△H3=-285.8 kJ·mol-1下列说法正确的是( )
A. C(s)+H2O(g)=CO(g)+H2(g) △H=-131.2kJ·mol-1
B. H2燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
C. 2H2O(g)=2H2(g)+O2(g) △H=-483.4kJ·mol-1
D. H2O(g)=H2O(l) △H=-44.1kJ·mol-1
难度: 中等查看答案及解析
-
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:N2(g)+2O2(g)====N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-542.7" kJ·mol-1
B. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 059.3 kJ·mol-1
C. N2H4(g)+1/2 N2O4(g) ====3/2N2(g)+2H2O(g)ΔH="-1" 076.7 kJ·mol-1
D. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 076.7kJ·mol-1
难度: 中等查看答案及解析
-
下列表述中正确的是( )

A. 根据图甲可知合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H1=(b-a)kJ·mol-1
B. 图乙表示2mol H2(g)所具有的能量比2mol气态水所具有的能量多483.6kJ
C. 1mol NaOH分别和1mol CH3COOH、1mol HNO3反应,后者比前者△H小
D. 汽油燃烧时将全部的化学能转化为热能
难度: 简单查看答案及解析
-
下列有关能量转换的说法正确的是( )
A.煤燃烧是化学能转化为热能的过程
B.化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C.动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D.植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
难度: 中等查看答案及解析
-
下列关于能量转换的认识中不正确的是
A.原电池工作时化学能全部转化为电能
B.工业上电解氧化铝制备铝,电能转化成化学能
C.镁在空气中燃烧时化学能不只转变成热能
D.绿色植物光合作用过程中太阳能转变成化学能
难度: 中等查看答案及解析
-
21世纪人类正由“化石能源时代”逐步向“多能源时代”过渡,下列不属于新能源的是
A.太阳能 B.核能 C.氢能 D.电力
难度: 简单查看答案及解析
-
下列说法中正确的是
A.中和热的测定实验中需要用的主要玻璃仪器有:两个大小相同的烧杯、两个大小相同的量筒、温度计、环形玻璃搅拌棒
B.可以用保温杯来代替烧杯做有关测定中和热的实验
C.在测定中和热的实验中,至少需要测定并记录温度的次数是3次
D.测定中和热实验中,若所使用的稀NaOH溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高
难度: 中等查看答案及解析
