-
符合如图中阴影部分的物质是( )

A. 碳酸氢钠 B. 碱式碳酸铜
C. 氯化钠 D. 碳酸钠
难度: 简单查看答案及解析
-
下列条件下,两瓶气体所含原子数一定相等的是( )
A. 同质量的乙烯和一氧化碳
B. 同体积、同密度的乙烯和丙烯
C. 同温度、同体积的氢气和氮气
D. 同压强、同体积的一氧化二氮和二氧化碳
难度: 简单查看答案及解析
-
Zn+
+OH-+H2O―→NH3↑+
配平后,离子方程式中H2O的化学计量数是( )
A. 2 B. 4 C. 6 D. 8
难度: 中等查看答案及解析
-
在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是( )
A. SO42- B. NH4+
C. Al3+ D. Ca2+
难度: 中等查看答案及解析
-
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A. 反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B. 根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C. 在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D. 可以推理得到Cl2+FeBr2 =FeCl2+Br2
难度: 中等查看答案及解析
-
依据阿伏加德罗定律,下列叙述中正确的是( )
A. 同温同压下,两种气体的体积之比等于摩尔质量之比
B. 同温同压下,两种气体的质量之比等于物质的量之比
C. 同温同压下,两种气体的物质的量之比等于密度之比
D. 同温同压下,两种气体的摩尔质量之比等于密度之比
难度: 中等查看答案及解析
-
关于氧化剂的叙述正确的是( )
A. 得电子越多,其氧化性越强
B. 分子中一定含有氧元素
C. 在反应中易失电子的物质
D. 在反应中易结合电子的物质
难度: 简单查看答案及解析
-
关于气体摩尔体积的下列描述中正确的是( )
A. 通常状况下的气体摩尔体积约为22.4 L·mol-1
B. 标准状况下,1 mol水所占的体积是22.4 L
C. 标准状况下,22.4 L的任何气体的物质的量都是1 mol
D. 相同物质的量的气体摩尔体积也相同
难度: 简单查看答案及解析
-
反应2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O中,还原剂与还原产物的物质的量之比为
A. 1:8 B. 8:1 C. 1:5 D. 5:1
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A. 洗净的容量瓶可以放进烘箱中烘干
B. 用带磨口玻璃瓶塞的玻璃保存NaOH溶液
C. 用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口放出
D. 用二硫化碳清洗残留在试管壁上少量的硫粉
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 20 ℃、1.01×105Pa时,同体积的O2和CO2含有相同数目的分子数
B. 1 mol气态物质,当体积为22.4 L时,该气体一定处于标准状况
C. 2 mol任何气体体积都约为44.8 L
D. 同温同压下,相同体积的任何气体单质所含分子数和原子数都相同
难度: 简单查看答案及解析
-
下列反应中,铁元素失去电子的是( )
A. FeS+2HCl===FeCl2+H2S↑
B. Fe+H2SO4===FeSO4+H2↑
C. FeO+2HCl===FeCl2+H2O
D. Fe2O3+3CO
2Fe+3CO2
难度: 中等查看答案及解析
-
科学家曾在英国《自然》杂志上报道,他们用DNA制造出一种臂长7 nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中的分散质的微粒直径和上述镊子的臂长具有相同数量级的是( )
A. 溶液 B. 悬浊液
C. 胶体 D. 乳浊液
难度: 简单查看答案及解析
-
已知amol H2和bmol H2O中所含的原子个数相等,则a∶b的值为( )
A. 1∶1 B. 1∶3
C. 3∶2 D. 任意比
难度: 简单查看答案及解析
-
下列有关化学药品的使用正确的是( )
A. 固体药品应盛放在细口瓶中
B. 将鼻孔凑到集气瓶口闻气体的气味
C. 给试管内液体加热,液体量不超过试管容积的三分之二
D. 一般用药匙或镊子取用固体药品
难度: 简单查看答案及解析
-
现有①MgSO4、②Ba(NO3)2、③NaOH、④CuCl2、⑤KCl五种溶液,不加任何其他试剂,被鉴别出的先后顺序正确的是( )
A. ④③①②⑤ B. ④⑤③②① C. ④③②①⑤ D. ④②③①⑤
难度: 简单查看答案及解析
-
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当产物n(NO2)∶n(NO)=1∶1时。下列说法正确的是
A. 1molCu2S参加反应时有8mol电子转移
B. 参加反应的n(Cu2S)∶n(HNO3)=1∶5
C. 反应中Cu2S既作氧化剂,又作还原剂
D. 产物n[Cu(NO3)2]∶n[CuSO4 ]=1∶1
难度: 中等查看答案及解析
-
下列实验操作正确的是
A. 当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好
B. 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管
C. 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液
D. 取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取
难度: 简单查看答案及解析
-
将30 mL 0.5 mol·L-1的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( )
A. 0.3 mol·L-1 B. 0.05 mol·L-1 C. 0.04 mol·L-1 D. 0.03 mol·L-1
难度: 中等查看答案及解析
-
下列实验操作所用仪器合理的是( )
A. 用25 mL烧杯量取14.80 mL 氢氧化钠溶液
B. 用10 mL量筒量取5.0 mL盐酸
C. 用托盘天平称取25.20 g 碳酸钠
D. 用100 mL容量瓶配制50 mL 0.10 mol·L-1氯化钠溶液
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 氢氧化钠的摩尔质量为40 g
B. 氢原子的摩尔质量是1 g·mol-1
C. 1 mol水的质量是18 g·mol-1
D. 二氧化碳的摩尔质量为44 g
难度: 简单查看答案及解析
-
工业上制取ClO2的化学反应:2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4。下列说法正确的是( )
A. SO2在反应中被氧化
B. NaClO3在反应中失去电子
C. H2SO4在反应中作氧化剂
D. 1 mol氧化剂在反应中得到2 mol电子
难度: 简单查看答案及解析
-
某同学在做实验时引发了镁失火,她立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧,发生2Mg+CO2
2MgO+C,下列关于该反应的判断正确的是( )
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性:CO2>MgO,还原性:Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于氧原子得到的电子数目
难度: 中等查看答案及解析
-
同温同压下,等质量的氧气和二氧化碳相比较,下列叙述正确的是( )
A. 质子数之比为1∶1 B. 密度比为11∶8
C. 物质的量之比为8∶11 D. 原子个数比1∶1
难度: 简单查看答案及解析
-
化学概念在逻辑上存在如图关系,对下列概念的说法正确的是( )

A. 化合物与氧化物属于交叉关系
B. 单质与非电解质属于包含关系
C. 溶液与分散系属于并列关系
D. 化合物与电解质属于包含关系
难度: 简单查看答案及解析
-
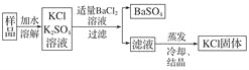
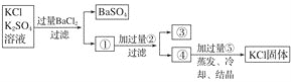
氢氧化钾是我国古代纺织业常用于漂洗的洗涤剂。古代制取氢氧化钾的流程如下:

在上述流程中没有涉及的化学反应类型是
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 中等查看答案及解析
-
下列说法正确的是
A. 氨气的水溶液能导电,所以氨气是电解质
B. 1 mol·L-1的硫酸钠溶液与1 mol·L-1的氢氧化钠溶液导电性不同
C. 氢氧化铁胶体能导电,故氢氧化铁胶体是电解质
D. 在相同条件下,饱和溶液一定比不饱和溶液的导电性强
难度: 简单查看答案及解析
-
某溶液中仅含有Na+、Mg2+、SO42-、Cl-四种离子(不考虑水电离出的H+和OH-),物质的量浓度之比为c(Na+)∶c(Mg2+)∶c(Cl-)=3∶5∶5。若Na+的物质的量浓度为3 mol·L-1,则SO42-的物质的量浓度为
A. 2 mol·L-1 B. 3 mol·L-1 C. 4 mol·L-1 D. 8 mol·L-1
难度: 简单查看答案及解析
-
相同条件下,ag的A气体与bg的B气体占有相同体积。下列叙述错误的是 ( )
A. a∶b等于A与B的相对分子质量之比
B. a∶b等于等质量的A与B的分子数之比
C. a∶b等于同温同压下A与B的密度之比
D. b∶a等于同温同体积等质量的A与B的压强比
难度: 中等查看答案及解析
-
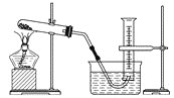
现有四组分散系:①汽油和水形成的乳浊液、②含有泥沙的食盐水、③溶有碘(I2)的碘化钾溶液、④乙二醇和丙三醇混合溶液(乙二醇和丙三醇的部分物理性质见下表)。
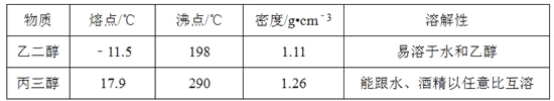
请用下图所示的仪器分离以上各混合液,仪器和方法不能对应的是( )

A. ①﹣(3)﹣分液
B. ②﹣(2)﹣过滤
C. ③﹣(2)﹣萃取
D. ④﹣(1)﹣蒸馏
难度: 简单查看答案及解析