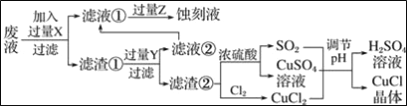
-
X、Y、Z、W、R属于短周期主族元素。X的原子半径在短周期主族元素中最大,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2∶1。下列叙述错误的是
A. X与Y形成的两种化合物中阴、阳离子的个数比均为1∶2
B. Y的氢化物比R的氢化物稳定,熔沸点高
C. Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z
D. RY2、WY2通入BaCl2溶液中均有白色沉淀生成
难度: 简单查看答案及解析
-
生活是化学的源泉。下列叙述不正确的是( )
A. 硅胶可用作食品干燥剂
B. 可溶性铜盐有毒,故人体内不存在铜元素
C. 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料
D. 中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质
难度: 中等查看答案及解析
-
下列关于物质的分类或变化说法正确的是
A.稀硫酸、NaCl溶液是实验室常见的强电解质
B.二氧化氮经加压凝成无色液体为物理变化
C.Na2O·SiO2是一种简单的硅酸盐,可溶于水
D.溴水滴入植物油中振荡褪色,说明溴被植物油从溴水中萃取出来
难度: 中等查看答案及解析
-
下列说法正确的是
A. 原子的最外层电子数等于族序数
B. 含共价键的化合物不一定是共价化合物
C. 分子结构相似的分子相对分子质量越大熔沸点一定越高
D. 元素的原子得电子越多非金属性越强,失电子越多,金属性越强
难度: 简单查看答案及解析
-
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
NH4+、Fe2+、SO42-
少量Ba(OH)2溶液
2NH4++SO42-+Ba2++2OH-===BaSO4↓+2NH3·H2O
B
Mg2+、HCO3-、Cl-
过量NaOH溶液
Mg2++2HCO3-+4OH-===2H2O+Mg(OH)2↓+2CO32-
C
K+、NH3·H2O、CO32-
通入少量CO2
2OH-+CO2===CO32-+H2O
D
Fe2+、NO3-、SO32-
NaHSO4溶液
SO32-+2H+===SO2↑+H2O
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列说法正确的是
A.某温度下纯水的pH=6,该温度下10 L pH=11的NaOH溶液中含OH-的数目为NA
B.以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2 L
C.在反应Zn+2HNO3+NH4NO3===N2↑+3H2O+Zn(NO3)2中每溶解1 mol Zn,转移的电子总数等于2NA
D.5.4 g Al分别与含溶质0.2 mol的NaOH溶液、盐酸反应,生成H2分子数均为0.3NA
难度: 简单查看答案及解析
-
下列实验误差分析错误的是( )
A. 用湿润的pH试纸测稀碱液的pH,测定值偏小
B. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
C. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
D. 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式是
A. NaNO2溶液中加入酸性KMnO4溶液:2MnO4﹣+5NO2﹣+6H+═2Mn2++5NO3﹣+3H2O
B. 碳酸氢铵溶液中加入足量氢氧化钡溶液:NH4++HCO3﹣+2OH﹣═CO32﹣+NH3•H2O+H2O
C. Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I﹣═2Fe2++I2
D. 用惰性电极电解熔融氯化钠:2Cl﹣+2H2O═Cl2↑+H2↑+2OH﹣
难度: 中等查看答案及解析
-
下列画有横线的反应物在反应中不能完全消耗的是
A. 将含少量CO2的CO通入足量Na2O2的试管并不断用电火花引燃
B. 向等物质的量的干冰和CaO的混合物中加几滴水
C. 将1molCu置于含2molH2SO4的浓硫酸中加热
D. 在强光持续照射下,向过量的Ca(ClO)2悬浊液中通入少量的CO2
难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ba(OH)2、KA1O2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
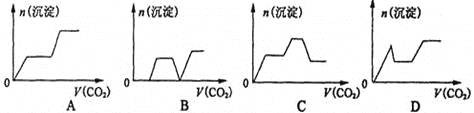
难度: 中等查看答案及解析
-
温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是

A. 前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B. 该反应的平衡常数表达式为K=c(C)c2(D)/[c(A)c(B)]
C. 若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D. 反应至15 min时,改变的条件可以是降低温度
难度: 中等查看答案及解析
-
下列表示物质组成和结构的化学用语正确的是
A. 乙烯的结构简式为:CH2CH2
B. H2O的电子式:
C. 葡萄糖的分子式:C12H22O11
D. 14C的原子结构示意图:
难度: 简单查看答案及解析
-
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=﹣443.64kJ•mol﹣1
2CO(g)+O2(g)=2CO2(g)△H2=﹣566.0kJ•mol﹣1
下列说法或热化学方程式正确的是
A. CO的燃烧热为566.0 kJ•mol﹣1
B. 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低
C. 完全燃烧20g甲醇,生成二氧化碳和液态水时放出的热量为908.3 kJ
D. 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H =﹣1453.28 kJ•mol﹣1
难度: 中等查看答案及解析
-
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:
Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-。某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:
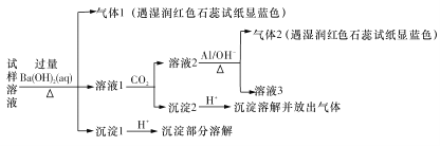
已知:3NO3-+8Al+5OH—+2H2O
3NH3↑+8A1O2—
根据以上的实验操作与现象,该同学得出的结论正确的是
A. 不能确定试样中是否含Al3+
B. 试样中肯定存在NH4+、Mg2+和SO42-,其他离子都不能确定
C. 要确定试样中是否有Na+存在,可做焰色反应实验,若焰色为紫色,则存在Na+
D. 沉淀2只可能是碳酸钡
难度: 困难查看答案及解析