-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 困难查看答案及解析
-
下列有关环境问题的做法错误的是
A. 生活污水使用明矾杀菌消毒 B. 向燃煤中加入适量石灰石“固硫”
C. 推广使用可降解塑料防止白色污染 D. 提倡公交出行可减少氮氧化物排放
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 质子数为78,中子数为117的铂原子:
B. 硫离子的结构示意图:
C. 碳酸的电离方程式H2CO3
2H++CO32—
D. N2H4的电子式:
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. MgO熔点高,可用于电解冶炼镁
B. 酒精具有挥发性,可用于消毒杀菌
C. Fe粉具有还原性,可用作食品袋中的抗氧化剂
D. SO2具有氧化性,常用于漂白秸秆、织物
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L−1的FeCl2溶液中:H+、Al3+、SO42—、ClO−
B. 无色透明的溶液中:Al3+、Fe3+、NO3—、SCN—
C. 与Al反应能放H2的溶液中:Cu2+、NH4+、CO32-、Cl−
D. c(OH−)/c(H+)=1×1014的溶液中:K+、Na+、I−、SiO32—
难度: 中等查看答案及解析
-
下列实验或原理不能达到实验目的的是
A. 制取氯气
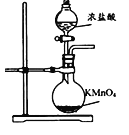 B. 除去氯气中的氯化氢
B. 除去氯气中的氯化氢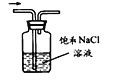 C. 氯气的尾气处理
C. 氯气的尾气处理 D. 测氯水的PH
D. 测氯水的PH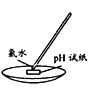
难度: 简单查看答案及解析
-
大气中氮氧化物和碳氢化合物受太阳紫外线作用可产生二次污染物——光化学烟雾,其中的反应之一为:CH3CH=CHCH3(2﹘丁烯)+2O3 → 2CH3CHO+2O2,下列说法正确的是
A. 分子式为C4H8的物质性质均与2﹘丁烯相同
B. 氧化性:O3>O2
C. 常温常压下,22.4L的2﹘丁烯中含C﹘H键数目为8×6.02×1023个
D. 1molO3参与该反应,转移的电子数为6×6.02×1023个
难度: 中等查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A. 用醋酸除去水垢:CaCO3+2H+==Ca2++H2O+CO2↑
B. 将Na2O2投入足量H2O中:2O22−+2H2O===4OH−+O2↑
C. 用强碱溶液吸收制取硝酸的尾气:NO+NO2+2OH−==2NO2−+H2O
D. 向莫尔盐[(NH4)2Fe(SO4)2·6H2O]溶液中加入过量氢氧化钠溶液:NH4++Fe2++3OH−NH3·H2O+Fe(OH)2↓
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
A.

B.

C.

D.

难度: 中等查看答案及解析
-
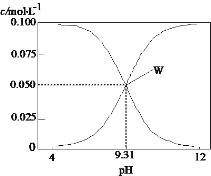
下列图示与对应的叙述相符的是
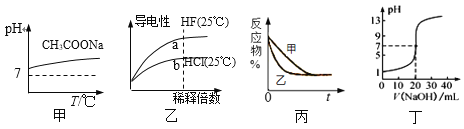
A. 图甲表示升高温度醋酸钠的水解程度增大,溶液碱性增强
B. 图乙表示氢氟酸为弱酸,且a点Kw的数值比b点Kw的数值大
C. 图丙表示压强对可逆反应2A(g) +2B(g)
3C(g)+D(s)的影响,乙的压强比甲的压强大
D. 图丁表示0.100 0 mol·L−1 NaOH溶液滴定20.00 mL 0.100 0 mol·L−1醋酸溶液的滴定曲线
难度: 困难查看答案及解析
-
下列说法正确的是
A. 298 K时,2H2S(g)+SO2(g)===3S(s)+2H2O(l) 能自发进行,则其ΔH<0
B. 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率
C. 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
D. 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液,溶液变红。
原Fe(NO3)2样品溶于酸前已氧化变质
B
T℃时,向等体积的饱和AgCl、AgI溶液中分别滴加足量AgNO3溶液,所得沉淀n(AgCl)>n(AgI)
T℃时,Ksp(AgCl)>Ksp(AgI)
C
向Na2SiO3溶液中滴加稀盐酸,出现白色胶状沉淀。
非金属性:Cl>Si
D
无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水,溴水褪色。
乙烯和溴水发生加成反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
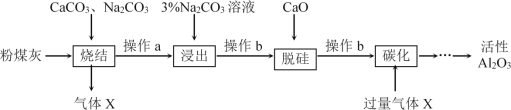
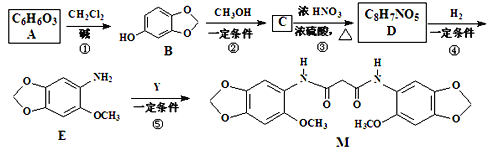
 ,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。
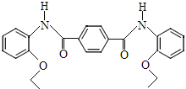
,写出制备的合成路线流程图 (无机试剂任用,合成路线流程图示例见本题题干)______________。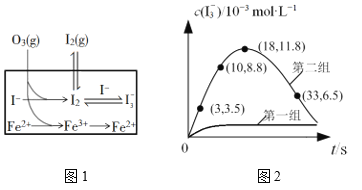
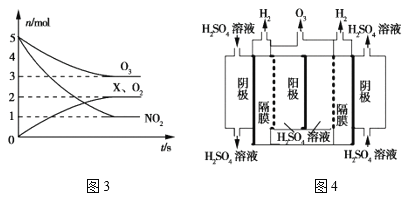
 。
。