-
化学与人类生产和生活密切相关,下列说法正确的是
A.聚乙烯塑料的老化是由于发生了加成反应
B.加碘食盐中加入的I2有利于防止地方缺碘病
C.二氧化硫有漂白性,常用作棉、麻、纸张的漂白
D.汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是
A.质子数为92、中子数为146的U原子:
B.HClO的结构式:H-Cl-O
C.35Cl-和37Cl-离子结构示意图均可以表示为:
D.HF的电子式:
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
设NA代表阿伏伽德罗常数的数值,则下列说法正确的是
A.常温常压下,1mol氦气含有的核外电子数为4NA
B.0.25molNa2O2中含有的阴离子数为0.5NA
C.50ml18.4mol/L浓硫酸与足量铜微热,生成气体0.46NA
D.25℃时,7gC2H4和C3H6的混合气体中,含有NA个C—H键
难度: 中等查看答案及解析
-
85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得诺贝尔生理学或医学奖。颁奖理由是“因为发现青蒿素── 一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命。”下列关于青蒿素和双氢青蒿素(结构如图)说法错误是
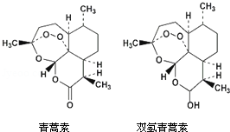
A.青蒿素和双氢青蒿素互为同分异构体
B.由青蒿素制备双氢青蒿素的反应属还原反应
C.青蒿素的分子式为C15H22O5
D.青蒿素分子中含有过氧链和酯基、醚键
难度: 中等查看答案及解析
-
下列有关化工生产的叙述中,正确的是
A.工业上可用氯化钠制备化肥NH4Cl
B.氯碱工业中,电解槽的阳极区产生NaOH
C.在接触室被氧化成SO3,SO3在吸收塔内被水吸收制成浓硫酸
D.工业上用石英制太阳能电池,在高温下用铝热法炼铁制备钢材
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,R与Y处于同一主族,Z是短周期中金属性最强的金属元素,W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水。下列说法正确的是
A.元素Y、Z、W的简单离子具有相同的电子层结构,其半径依次增大
B.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
C.元素X与元素Y能形成两种化学键类型完全相同的化合物
D.元素X、Z形成化合物的电子式可以表示成
难度: 中等查看答案及解析
-
氨基钠和氢化钠与水反应的化学方程式如下:①NaNH2+H2O==NaOH+NH3↑②NaH+H2O==NaOH+H2↑,下列叙述正确的是
A.氨基钠和氢化钠与盐酸反应都只生成一种盐
B.方程式②中,每生成1mol H2转移1 mol电子
C.氨基钠和氢化钠的晶体中都只含离子键
D.方程式①中,氨基钠是还原剂
难度: 中等查看答案及解析
-
常温下,下列溶液中,能大量共存的一组离子是
A.pH=1的溶液中:NH4+ 、Fe2+ 、SO42-、Cl-
B.通入SO2气体的溶液中:Ca2+、I-、ClO-、NO3-
C.c(Fe3+)= 0.1 mol•L-1的溶液中 :Na+、I-、SCN-、SO42-
D.由水电离出的c(H+)=1.0×10-13 mol•L-1 的溶液中:Na+、HCO3-、Cl-、Br-
难度: 中等查看答案及解析
-
亚氯酸钠是一种高效氧化剂漂白剂,主要用于棉纺、亚麻纸浆等漂白.亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2﹣、Cl﹣等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体.经测定,25℃时各组分含量随pH变化情况如图所示(Cl﹣没有画出).则下列分析正确的是
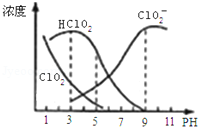
A.亚氯酸钠在酸性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10﹣6
C.pH越大,该漂白剂的漂白性能越好
D.25℃,pH=3时,NaClO2溶液中:c(Na+)+c(H+)=c(ClO2-)+c(OH-)
难度: 困难查看答案及解析
-
下列表示化学反应的离子方程式,其中正确的是
A.NH4HSO3溶液与足量NaOH溶液共热:NH4++HSO3-+2OH-
NH3↑+SO32-+2H2O
B.向氯化铝溶液中加入过量氨水:Al3+ + 4NH3·H2O == AlO2- + 4NH4+ +2H2O
C.用盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2 MnO4-+6H++ 5H2O2==2Mn2++5 O2 ↑+ 8H2O
D.用石墨电极电解饱和MgCl2溶液:2Cl-+2H2O
H2↑+ Cl2↑ + 2OH-
难度: 中等查看答案及解析
-
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1﹣xCoO2
C6+LiCoO2.下列说法不正确的是

A.据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边
B.充电时,A为阴极,发生还原反应
C.放电时,B为正极,电极反应式为:Li1﹣xCoO2+xLi++xe﹣=LiCoO2
D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收
难度: 困难查看答案及解析
-
在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝,在上述溶液中加入足量的亚硫酸钠溶液,蓝色逐渐消失.下列判断不正确的是
A.氧化性:ClO﹣>I2>SO42﹣
B.漂白粉溶液可使淀粉碘化钾试纸变蓝
C.次氯酸钠可以与亚硫酸钠共存
D.向氯水中加入亚硫酸钠溶液,氯水褪色
难度: 中等查看答案及解析
-
常见的无机酸25℃时在水溶液中的电离平衡常数如下表,下列选项正确的是
氢氰酸(HCN)
碳酸(H2CO3)
氢氟酸(HF)
K = 6.2×10-10
Ka1= 4.2×10-7
K=6.61×10-4
A.氟化钠溶液中通入CO2:2F-+H2O+CO2=2HF+CO32-
B.NaCN与HCN的混合溶液中:2c(Na+) = c(CN-)+ c(HCN)
C.0.2 mol•L-1 HCN溶液与0.1 mol•L-1NaOH溶液等体积混合后,溶液的pH>7
D.25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者
难度: 中等查看答案及解析
-
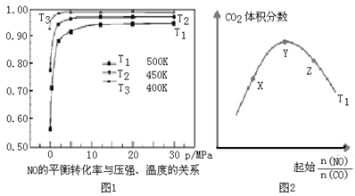
一定条件下合成乙烯: 6 H2(g) +2CO2(g)
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
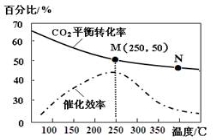
A.生成乙烯的速率:v(M)一定小于v(N)
B.化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
难度: 困难查看答案及解析
-
在容积不变的密闭容器中进行反应:
2SO2(g)+O2(g)
2SO3(g) △H<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是

A.图I表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D.图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
难度: 中等查看答案及解析
-
下列说法不正确的是
A.探究温度对反应速率影响时,分别水浴加热硫代硫酸钠溶液、硫酸溶液到一定温度,再将两溶液混合
B.用简易量热计测定反应热,使用碎泡沫隔热保温、环形玻璃搅拌棒搅拌、量取达到的最高温度,计算反应热,取2~3 次的实验平均值
C.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快
D.欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)分别为中和滴定实验和pH试纸
难度: 中等查看答案及解析
-
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是
A.原溶液中一定含有Br-、SO42-
B.原溶液一定含有Na+,不含Ba2+
C.实验①与上述离子的检验无关,可以省略
D.若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3
难度: 困难查看答案及解析