-
对下列物质:①纯碱 ②食盐水 ③浓硫酸 ④烧碱 ⑤液态氧 ⑥氯酸钾,分类全部正确的是
A. 碱——①④ B. 混合物——②③
C. 电解质——③④⑤ D. 盐——②⑥
难度: 简单查看答案及解析
-
下列有关化学实验操作正确的是

A. 检验K+的存在 B. 干燥CO2 C. 分离溴与CCl4 D. 蒸发食盐水
难度: 简单查看答案及解析
-
下列各组混合物中,能用分液漏斗进行分离的是
A. 乙醇和水 B. 汽油和煤油
C. 碘和四氯化碳 D. 色拉油和水
难度: 简单查看答案及解析
-
下列化学反应中,属于氧化还原反应的是
A. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ B. KCl+AgNO3=AgCl↓+KNO3
C. 4NH3+5O2
4NO+6H2O D. CaCO3
CaO+CO2↑
难度: 简单查看答案及解析
-
下列有关“化学与生活”的叙述正确的是
A. 生石灰和碱石灰均可用作食品干燥剂
B. Fe(OH)3胶体无色、透明,能产生丁达尔现象
C. 用含硅胶、铁粉的透气小袋与食品一起密封包装, 该过程没有发生化学反应
D. 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理
难度: 中等查看答案及解析
-
下列离子检验的方法正确的是
A. 某溶液
 有白色沉淀,说明原溶液中有Cl-
有白色沉淀,说明原溶液中有Cl-B. 某溶液
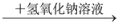 有蓝色沉淀,说明原溶液中有Cu2+
有蓝色沉淀,说明原溶液中有Cu2+C. 某溶液
有白色沉淀,说明原溶液中有SO42-
D. 某溶液
生成无色气体,说明原溶液中有CO32-
难度: 中等查看答案及解析
-
下列溶液中,跟100 mL 0.5mol•L -1 NaCl溶液所含的Cl-物质的量浓度相同的是
A. 100 mL0.5mol•L-1 MgCl2溶液 B. 200 mL1mol•L-1 CaCl2溶液
C. 50 mL1mol•L-1 NaCl溶液 D. 25 mL0.5mol•L-1 HCl溶液
难度: 简单查看答案及解析
-
科学的实验方法为我们探索物质世界提供了金钥匙。下列实验方法不正确的是
A. 容量瓶使用前必须检查是否漏液
B. 蒸发结晶时应将溶液蒸干
C. 用一根洁净的铂丝蘸取碳酸钠溶液,置于酒精灯火焰上灼烧可以检验钠离子
D. 用洁净的玻璃棒蘸取溶液滴在pH试纸上,跟标准比色卡对照可测定溶液的pH
难度: 简单查看答案及解析
-
在化合、分解、置换、复分解等四类反应中,只选用同一类反应,不能实现的变化是
A. Cu→Cu(OH)2 B. C→H2CO3
C. FeCl3→Fe2(SO4)3 D. MgCO3→Mg(OH)2
难度: 中等查看答案及解析
-
V L浓度为1.000 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是
A. 通入标准状况下的HCl气体22.4V L
B. 将溶液加热浓缩到0.5V L
C. 加入10.00 mol·L-1的盐酸0.2V L,再稀释至1.5V L
D. 加入V L 3 mol·L-1的盐酸混合均匀
难度: 困难查看答案及解析
-
某同学在实验室进行了如图所示的实验,下列说法中错误的是
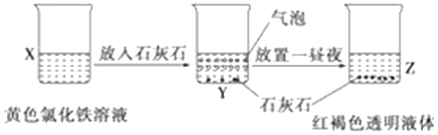
A. X、Z烧杯中分散质相同
B. 利用过滤的方法,可将Z中固体与液体分离
C. Y中产生的气体为CO2
D. Z中分散系能产生丁达尔效应
难度: 中等查看答案及解析
-
在浓度均为4.0 mol·L-1的盐酸和硫酸各100 mL溶液中,分别加入等质量的锌粉,充分反应后生成气体体积比为2∶3,则加入锌粉的质量是
A. 6.5 g B. 13.0 g C. 19.5 g D. 26.0 g
难度: 困难查看答案及解析
