-
下列叙述正确的是
A. 石英坩埚、水泥和陶瓷都是硅酸盐产品
B. “84”消毒液的有效成分是 NaClO,“洁厕灵”的有效成分为 HCl,若将两者混合使用,其杀菌效果和去除厕所污渍的效果都将加强
C. “玉兔号”月球车太阳能电池帆板的材料是二氧化硅
D. 高铁车厢大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点
难度: 简单查看答案及解析
-
设 NA表示阿伏加徳罗常数的值。下列说法不正确的是
A. 常温下的新制氯水中,若含有的Cl-数为 NA,则其中含有的 ClO-数也为NA
B. 12.0 g熔融的NaHSO4中含有的阳离子数为0.1NA
C. 一定条件下,1.0 mol Cl2与足量铁完全反应转移的电子数为2 NA
D. 78 g Na2O2与足量CO2完全反应时转移的电子数为NA
难度: 中等查看答案及解析
-
除去下列括号内杂质的试剂或方法不正确的是
A. Fe2+(Fe3+):还原铁粉,过滤
B. Cl2(HCl):饱和食盐水,洗气
C. Na2O2粉末(Na2O):将混合物在氧气中充分加热
D. HNO3溶液(H2SO4):适量 BaCl2溶液,过滤
难度: 简单查看答案及解析
-
下列说法正确的是
①NH3的水溶液能导电,故NH3是电解质 ②向含有BaCl2和NaOH的混合溶液中通入少量的二氧化硫气体,有白色沉淀生成 ③101 KPa、150℃时,agCO和H2的混合气体在足量的O2中完全燃烧,将燃烧后的产物通入足量的Na2O2固体后,Na2O2增重ag ④碱性氧化物一定是金属氧化物 ⑤22.4L的CO气体和28g N2所含的电子数相等 ⑥根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液 ⑦为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 ⑧氧化还原中,有一种元素被氧化,一定有另一种元素被还原
A.②③④ B.②④⑦⑧ C.①⑤⑥⑦ D.③⑤⑥⑧
难度: 中等查看答案及解析
-
可确认发生了化学平衡移动的是
A. 化学反应速率发生了改变
B. 有气态物质参加的可逆反应达到平衡后,改变了压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D. 可逆反应达到平衡后,使用催化剂
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 绿色化学的核心就是在生产过程中减少污染
B. 形成酸雨的主要物质是硫氧化物和氮氧化物(NOx)
C. 大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
D. 水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的
难度: 中等查看答案及解析
-
某原电池总反应为Cu+2Fe3+=Cu2++2Fe2+,下列能实现该反应的原电池是
选项
A
B
C
D
电极材料
Cu、Zn
Cu、C
Fe、Zn
Cu、Ag
电解液
FeCl3
Fe(NO3)2
CuSO4
Fe2(SO4)3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
已知
有相同容积的定容密封容器甲和乙,甲中加入
和
各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( )
A.甲、乙提高相同温度 B. 甲中加入0.1mol He,乙不改变
C.甲降低温度,乙不变 D. 甲增加0.1mol
,乙增加0.1mol I2
难度: 中等查看答案及解析
-
下列有关化学用语的表示方法中正确的是( )
A. 次氯酸的电子式:
B. Na+的结构示意图:
C. 用电子式表示MgCl2的形成过程为:

D. M2+离子核外有a个电子,b个中子,M原子符号为
难度: 中等查看答案及解析
-
化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( )

A. 化学反应中能量变化的主要原因是化学键的断裂与生成
B. 铝热反应中,反应物的总能量比生成物的总能量低
C. 图I所示的装置能将化学能转变为电能
D. 图II所示的反应为吸热反应
难度: 简单查看答案及解析
-
下列实验能达到目的的是
A
B
C
D
实验室制备Fe(OH)2
实验室制氨气
制过氧化钠
验证浓H2SO4的脱水性、强氧化性
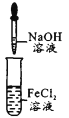
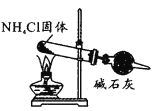
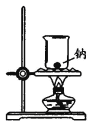
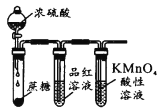
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关叙述正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C. 2H2(g)+O2(g)=2H2O(g)ΔH<0且ΔS>0,能自发进行
D. 浓硫酸的稀释和铝热反应均为放热反应
难度: 简单查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是
选项
事实
推测
A
Mg与水反应缓慢,Ca与水反应较快
Ba与水反应会更快
B
Si是半导体材料,同族的Ge也是半导体材料
第ⅣA族的元素的单质都可作半导体材料
C
HCl在1500℃时分解,HI在230℃时分解
HBr的分解温度介于二者之间
D
Si与H2高温时反应,S与H2加热能反应
P与H2在高温时能反应
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下表所列各组物质中,物质之间不能通过一步反应实现如图转化的是
A
B
C
D
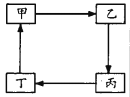
甲
Cu
Na2CO3
Fe
NaAlO2
乙
CuO
NaOH
FeCl3
Al2O3
丙
CuSO4
NaHCO3
FeCl2
AlCl3
丁
Cu(NO3)2
CO2
Fe(NO3)2
Al(OH)3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
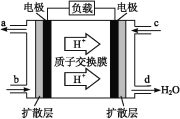
Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是
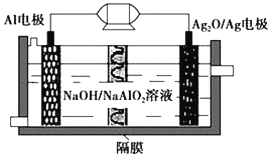
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子数目为0.1NA
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
难度: 中等查看答案及解析
-
下列通过实验观察得到的结论正确的是
选项
实验操作
结论
A
AlCl3溶液中逐滴滴加NaOH溶液至过量
Al(OH)3能溶于强碱溶液
B
铝、镁用导线连接后投入NaOH溶液中,铝表面有气泡
铝比镁更活泼
C
硅既能与氢氟酸反应,也能与NaOH溶液反应
单质硅是两性物质
D
铁粉与水蒸气反应后固体加稀HCl溶解,再加KSCN溶液,溶液不变红
反应后固体中不含+3价的铁
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
在一个恒温的固定容积的密闭容器中,发生可逆反应mA(g)+nB(g)
pC(g)+qD(s),当m、n、p、q为任意整数时,一定达到平衡的标志是( )
①体系的温度不再改变 ②气体总质量不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q
⑥混合气体密度不再改变
A. ③④⑤⑥ B. ②③④⑥ C. ①②④⑥ D. ①③④⑥
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,Y和Z位于同一主族。m、n、p均为由这些元素组成的二元化合物,甲、乙、丙为其中三种元素对应的单质,丙为淡黄色固体,易溶在XZ2中,n是一种二元弱酸。上述物质的转化关系如图所示(反应条件省略)。下列说法正确的是
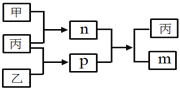
A. 原子半径:W<X<Y B. 非金属性:Y>Z>X
C. Y与Z组成的化合物一定有漂白性 D. W与X组成的化合物中只有极性键
难度: 困难查看答案及解析
-
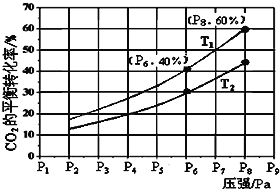
如图所示,与对应的叙述相符的是
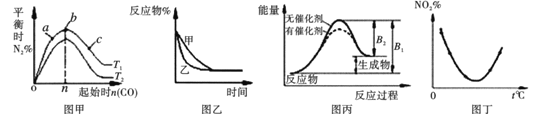
A. 图甲表示反应:4CO(g) +2NO2(g)==N2(g) +4CO2(g) ΔH<0,在其他条件不变的情况下,改变起始物CO的物质的量对此反应平衡的影响,则有T1<T2,b点处NO2的转化率最大
B. 图乙表示某条件对2A(g) +B(g)==3C(g)的影响,乙一定使用了催化剂
C. 图丙表示的某可逆反应是吸热反应,该图表明催化剂能同时改变正逆反应的活化能
D. 图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的ΔH>0
难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表,建立平衡需要的时间为20 s,则下列说法不正确的是
物质
X
Y
Z
初始浓度/(mol·L-1)
0.2
0.1
0.1
平衡浓度/(mol·L-1)
0.05
0.05
0.2
A. 反应可表示为3X+Y
2Z
B. 建立平衡过程中,用Z表示的反应速率为v(Z)=0.005 mol·L-1·s-1
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 若初始浓度:X为0.2 mol·L-1,Y为0.2 mol·L-1,Z为0.8mol·L-1,则平衡向右移动
难度: 中等查看答案及解析