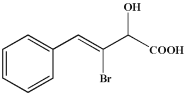
-
某学生进行蔗糖的水解实验,并检验水解产物中是否含有葡萄糖。他的操作如下:取少量纯蔗糖加配成溶液;在蔗糖溶液中加入3~5滴稀硫酸;将混合液煮沸几分钟、冷却;在冷却后的溶液中加入银氨,在水浴中加热。实验结果没有银镜产生。其原因是
A. 蔗糖尚未水解 B. 蔗糖水解的产物中没有葡萄糖
C. 加热时间不够 D. 煮沸后的溶液中没有加碱,以中和作催化剂的酸
难度: 中等查看答案及解析
-
下列物质中均既有离子键又有共价键的一组是
A. NaOH、H2O、NH4Cl B. KOH、Na2O2、NH4Cl
C. MgO、CaBr2、NaCl D. Na2SO4、HCl、MgCl2
难度: 中等查看答案及解析
-
碘元素的一种核素
I可用于治疗肿瘤,下列有关
I的说法正确的是( )
A. 质量数是53 B. 质子数是125 C. 中子数是125 D. 电子数是53
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. PM2.5、二氧化碳都属于空气质量日报的内容
B. 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量
C. 对“地沟油”进行分馏可得到汽油
D. “光化学烟雾”、“硝酸型酸雨”的形成都与氮氧化合物有关
难度: 简单查看答案及解析
-
家用84消毒液的有效成分是( )
A. NaClO B. NaCl C. Ca(ClO)2 D. HClO
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 标准状况下,22.4L四氯化碳中含有C﹣Cl数目为4NA
B. 1molCl2通入足量水中反应转移的电子数为NA
C. 常温下,0.5mol•L﹣1Fe2(SO4)3溶液中含Fe3+数目为NA
D. 常温常压下,5.6g丙烯和环丙烷的混合气体中含有的碳原子数为0.4NA
难度: 困难查看答案及解析
-
分子式为C5H12O且可与金属钠反应放出氢气的有机化合物有(不考虑立体异构) ( )
A. 6种 B. 7种 C. 8种 D. 9种
难度: 困难查看答案及解析
-
下列物质既能由金属和酸反应获得,也能通过金属和氯气反应获得的是
A. CuCl2 B. FeCl2 C. FeCl3 D. AlCl3
难度: 简单查看答案及解析
-
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压)取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是( )

编号
①
②
③
④
气体M
HI
NH3
H2
NO
气体N
Cl2
HCl
N2
O2
A. ①②③④ B. ③①④② C. ④①②③ D. ①④③②
难度: 困难查看答案及解析
-
如图所示,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是( )
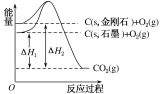
A. C(s,石墨)===C(s,金刚石) ΔH=+1.9kJ·mol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1mol石墨的能量比1 mol金刚石的能量大
难度: 中等查看答案及解析
-
下列有关工业生产的叙述不正确的是( )
A. 用海水淡化后的浓缩海水作原料提取溴
B. 在太阳能资源相对充足的沿海地区建造海水淡化厂
C. 利用“海水→氯化钠→金属钠→氢氧化钠”的工艺流程生产烧碱
D. 利用“海水→氢氧化镁→氯化镁→金属镁”的工艺流程生产金属镁
难度: 中等查看答案及解析
-
下列关于化石燃料及其使用的一些说法不正确的是( )
A. 煤的气化是指将固态煤粉碎成气态煤,使煤燃烧时能与氧气充分接触而完全燃烧
B. 天然气除可用作清洁能源外,还可用于合成氨和生产甲醇等
C. 石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
D. 化石燃料也是重要的化工原料,乙烯和苯就是分别来自石油和煤的基本化工原料
难度: 简单查看答案及解析
-
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关,下列说法中不正确的是( )
A. 由Zn、Cu、稀H2SO4组成原电池,放电时SO42﹣向Zn电极移动
B. 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al﹣3e+4OH﹣═AlO2﹣+2H2O
C. 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu﹣2e﹣═Cu2+
D. 由Al、Cu、浓硝酸组成原电池作电源,其负极反应式为:Cu﹣2e﹣═Cu2+
难度: 困难查看答案及解析
-
下列叙述不正确的是( )
①由于氢键的原因,热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素金属阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
⑦含有阴离子的化合物一定含有阳离子
A. ②③④⑦ B. ①②⑤⑦ C. ②④⑥ D. ①⑤⑥
难度: 中等查看答案及解析
-
在密闭容器中进行如下可逆反应:X2(g)+Y2(g)⇌2XY(g),已知X2、Y2、XY三者起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下反应处于平衡,此时容器中不可能的情况是( )
A. X2为0.2mol/L B. Y2为0.35mol/L C. XY为0.3mol/L D. X2、Y2、XY总浓度为0.6mol/L
难度: 困难查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
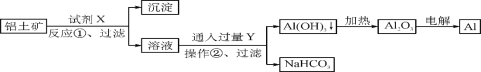
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
难度: 中等查看答案及解析
-
用CH4催化还原NOx可以消除氮氧化物的污染。
已知CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1,
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1。若在标准状况下4.48 L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
A. 173.4 kJ B. 232 kJ C. 368.8 kJ D. 114.8 kJ
难度: 中等查看答案及解析