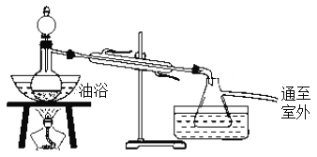
-
下列反应既是氧化还原反应,又是吸热反应的是
A. 铝片与稀H2SO4反应 B. Ba(OH)2·8H2O与NH4Cl反应
C. 灼热的炭与CO2反应 D. 甲烷在O2中的燃烧反应
难度: 中等查看答案及解析
-
短周期金属元素甲~戊在元素周期表中的相对位置如下表所示。下列判断正确的是( )
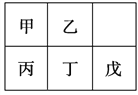
A. 原子半径:丙<丁<戊 B. 金属性:甲>丙
C. 氢氧化物碱性:丙>丁>戊 D. 最外层电子数:甲>乙
难度: 中等查看答案及解析
-
将氢气通入10 g 氧化铜粉末加热片刻,冷却后剩余固体的质量为8.4 g,下列计算正确的是
A. 有1.6 g 水生成
B. 有8.4 g 铜生成
C. 有80%的氧化铜被还原
D. 实验时所消耗的氢气不足0.2 g
难度: 简单查看答案及解析
-
等质量的固体硫和硫蒸气分别在相同条件下完全燃烧,放出的热量( )
A. 前者多 B. 后者多 C. 两者相等 D. 无法比较
难度: 中等查看答案及解析
-
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)
2NH3(g),反应过程如下图所示,下列说法正确的是
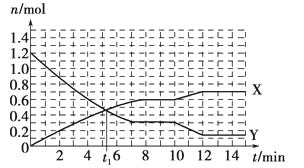
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=3/4 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率v(N2)=0.25 mol·L-1·min-1
难度: 简单查看答案及解析
-
用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是
A. 加热
B. 不用铁片,改用等质量的铁粉
C. 滴加少量的CuSO4溶液
D. 不用稀硫酸,改用98%浓硫酸
难度: 简单查看答案及解析
-
两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是( )
A. A的金属性强于B
B. 电子不断由A电极经外电路流向B电极
C. A电极上发生的电极反应是还原反应
D. A的金属活动性一定排在氢前面
难度: 简单查看答案及解析
-
根据反应:2Ag++Cu=Cu2++2Ag,设计如图所示原电池,下列说法错误的是( )
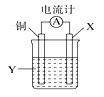
A. X可以是银或石墨
B. Y是硫酸铜溶液
C. 电子从铜电极经外电路流向X电极
D. X极上的电极反应式为:Ag++e-=Ag
难度: 中等查看答案及解析
-
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:负极Pb+SO42- ====PbSO4+2e-,正极PbO2+4H++SO42-+2e-===PbSO4+2H2O今若制得Cl2 0.050mol,这时电池内消耗的H2SO4的物质的量至少是( )
A. 0.025 mol B. 0.050 mol C. 0.10 mol D. 0.20 mol
难度: 中等查看答案及解析
-
下列关于有机物的说法中错误的是
A.乙烷和乙烯都能与氢气在一定条件下发生加成反应
B.苯和乙烯都能使溴水褪色,但其原理是不同的
C.甲烷和乙醇均能发生取代反应
D.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
难度: 中等查看答案及解析
-
已知最外层电子数相等的元素原子具有相似的化学性质。氧元素原子的核外电子分层排布示意图为
 。下列原子中,与氧元素原子的化学性质相似的是
。下列原子中,与氧元素原子的化学性质相似的是A.
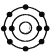 B.
B. 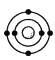 C.
C. 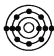 D.
D. 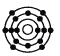
难度: 简单查看答案及解析
-
为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
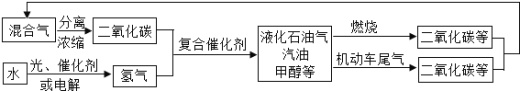
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是守恒的;②燃烧时化学能可以转化为热能和光能;③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;⑤二氧化碳也是一种重要的资源.A.①②③ B.①②④⑤ C.①④⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
蛋白质和淀粉都是高分子化合物
蛋白质和淀粉水解最终产物均是葡萄糖
B
汽油和植物油都属于烃
汽油和植物油都可以燃烧
C
盐酸和氨水能溶解Al(OH)3
Al(OH)3是两性氢氧化物
D
铝具有还原性
铝粉和氧化铁粉末可发生铝热反应
难度: 简单查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成CO2和H2O
③石油的分馏、煤的气化和液化都是物理变化
④淀粉和纤维素水解的最终产物都是葡萄糖
⑤除去CH4中的少量C2H4,可将混合气体通过盛有溴水的洗气瓶
A. ③⑤ B. ④⑤ C. ①② D. ②④
难度: 简单查看答案及解析
-
A、B两元素可形成AB型化合物,已知A和B的离子不具有相同的电子层结构,A原子的最外层比B原子最外层少4个电子,B原子次外层比A原子次外层少6个电子。则AB可能是
A. MgO B. KCl C. CaO D. MgS
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A. 构成原电池正极和负极的材料必须是两种金属
B. 把铜片和铁片紧靠在起浸入稀硫酸中,铜片表面出现气泡
C. 把铜片插入三氯化铁溶液中,在铜片表面不会出现一层铁
D. 把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
难度: 简单查看答案及解析
-
可逆反应:2NO2
2NO+O2在固定体积的密闭容器中反应,达到平衡状态的标志是
(1)单位时间内生成n mol O2的同时,生成2n mol NO2
(2)单位时间内生成n mol O2的同时,生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态
A. 仅(1)(4)(5) B. 仅(2)(3)(5)
C. 仅(1)(3)(4) D. (1)(2)(3)(4)(5)
难度: 中等查看答案及解析
-
下列说法中错误的是
A. 烷烃的通式是CnH2n+2,所以符合此通式的烃一定是烷烃
B. 碳原子数相同的烯烃和烷烃是同分异构体
C. 烯烃中碳的质量分数一定大于烷烃中碳的质量分数
D. 烯烃易发生加成反应,烷烃能发生取代反应
难度: 简单查看答案及解析