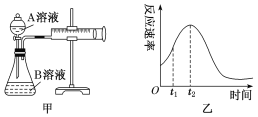
-
科学家预测原子序数为114的元素,具有相当稳定性的同位素,它的位置在第7周期IVA族,称为类铅。关于它的性质,预测错误的是
A. 它的最外层电子数为4 B. 它的金属性比铅强
C. 它具有+2、+4价 D. 它的最高价氧化物的水化物是强酸
难度: 困难查看答案及解析
-
我国科学家首次合成的一种过渡金属的新核素Hf,具有延展性,不易被腐蚀,可应用于高科技领域等特点。185Hf可由180Hf转化而成,下列有关180Hf、185Hf的说法正确的是( )
A. 物质的量相等的185Hf与180Hf质量相同
B. 核外电子数分别为108、113
C. 1 mol180Hf比1 mol185Hf的中子数少5NA
D. 180Hf、185Hf在周期表中的位置不同
难度: 中等查看答案及解析
-
下列化学用语表达正确的是:
A. 氯离子的结构示意图:
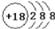
B. HClO的结构式为:H﹣Cl﹣O
C. 氯化镁的电子式:

D. 由非金属元素组成的化合物一定不是离子化合物
难度: 简单查看答案及解析
-
为消除目前燃料燃烧时产生的环境污染,同时缓解能源危机,有关专家提出了利用太阳能制取氢能的构想。下列说法正确的是:
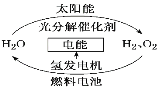
A. H2O的分解反应是放热反应
B. 氢能源已被普遍使用
C. 2 mol液态H2O具有的总能量低于2 mol H2和1 mol O2的能量
D. 氢氧燃料电池放电过程中是将电能转化为化学能
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 对于A(s)+B(g)
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g)
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
难度: 中等查看答案及解析
-
下列实验操作和结论说法正确的是:
选项
实验
结论
A
除去甲烷中的乙烯杂质,可将混合气体通过酸性高锰酸钾溶液
乙烯含有碳碳双键,能与酸性高锰酸钾反应,甲烷不反应
B
乙醇和水都可与金属钠反应产生可燃性气体
乙醇分子中的氢与水分子中的氢具有相同的活性
C
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2二溴乙烷无色、可溶于四氯化碳
D
用乙酸浸泡水壶中的水垢,可将其清除
乙酸的酸性小于碳酸的酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是:
A. 分子式为C7H8,分子中含有苯环的烃的一氯代物有4种
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH
C17H35COOC2H5+H218O
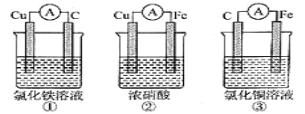
C. 如图所示实验可证明元素的非金属性:Cl>C>Si

D. C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点正丁烷低于异丁烷
难度: 中等查看答案及解析
-
在298 K时,实验测得溶液中的反应:H2O2+2HI===2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
实验编号
1
2
3
4
5
c(HI)/mol·L-1
0.100
0.200
0.300
0.100
0.100
c(H2O2)/mol·L-1
0.100
0.100
0.100
0.200
0.300
v/mol·L-1·s-1
0.007 60
0.015 3
0.022 7
0.015 1
0.022 8
A. 0.152 mol·L-1·s-1 B. 0.038 0 mol·L-1·s-1
C. 0.608 mol·L-1·s-1 D. 0.760 mol·L-1·s-1
难度: 中等查看答案及解析
-
在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
难度: 困难查看答案及解析
-
短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅡA族,W 与X属于同一主族。下列说法正确的是( )
A. 离子半径:r(W) > r(Z) > r(Y)
B. X、W 的简单氢化物的沸点:X>W
C. Y 的最高价氧化物对应水化物的碱性比Z的弱
D. 由X、Y 组成的化合物一定含离子键和共价键
难度: 中等查看答案及解析
-
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量的变化如图所示,则下列对混合烃的判断正确的是:

①一定有乙烯 ②一定有甲烷 ③一定有丙烷 ④一定没有乙烷⑤可能有甲烷 ⑥可能有乙炔(C2H2)
A. ②④ B. ②③⑥ C. ②⑥ D. ①③⑤
难度: 中等查看答案及解析
-
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:
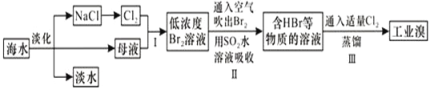
A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
难度: 中等查看答案及解析
-
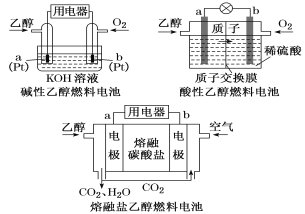
利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。下列说法正确的是
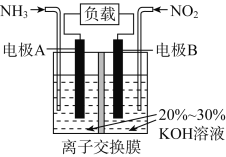
A. 电流从左侧电极经过负载后流向右侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-===N2+6H+
D. 当有4.48 L NO2被处理时,转移电子数为0.8NA
难度: 困难查看答案及解析
-
下列说法正确的是:
A. 聚乙烯可以使酸性高锰酸钾溶液褪色
B. 1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共可以消耗氯气 5mol
C. 油脂、糖类和蛋白质都能发生水解反应
D. 制取溴苯:将铁屑、溴水、苯混合加热
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是:
A.
和
互为同分异构体
B. 15g甲基(﹣CH3)含有的电子数是9NA
C. 7.8g苯中含有的碳碳双键数为0.3NA
D. 标准状况下,2.24 L CCl4中的原子总数为0.5NA
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在体积为2 L的密闭容器中混合,并在一定条件下发生反应:2A(g)+B(g)
xC(g),若经2 s后测得A的物质的量为2.8 mol,C的物质的量浓度为0.6 mol/L。现有下列几种说法:
①2 s内用物质A表示的平均反应速率为0.3 mol/(L·s);
②2 s内用物质B表示的平均反应速率为0.15 mol/(L·min)
③2 s时物质B的转化率为70%;
④x=2。
其中正确的是:
A. ①④ B. ②③ C. ①②③ D. ①②④
难度: 中等查看答案及解析