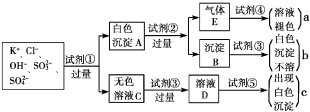
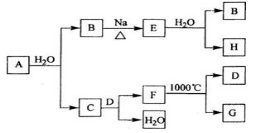
-
下列说法中错误的是( )
A.磺化、硝化、风化、钝化都是化学变化
B.蒸馏、干馏、常压分馏、减压分馏、都是物理变化
C.甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰
D.水煤气、裂解气、焦炉气、天然气都是混合物
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA
C.7.8 g Na2O2含有的阴离子数目为0.1 NA
D.80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4NA
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A 二氧化硅的分子式:SiO2
B质子数为53,中子数为78的碘原子:
C甲基的电子式:
D邻羟基苯甲酸的结构简式:
难度: 简单查看答案及解析
-
实验室里需用480 mL 0.10 mol·L-1 CuSO4溶液,现选用500 mL容量瓶进行配制,以下操作正确的是( )
A.称取7.68 g硫酸铜,加入500 mL水
B.称取12.0 g胆矾配制500 mL溶液
C.称取8.0 g硫酸铜,加入500 mL水
D.称取12.5 g 胆矾配制500 mL溶液
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.向饱和碳酸氢钙溶液中加入过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
B.KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:
2Al3++3 SO42-+3 Ba2++6 OH-=2Al(OH)3↓ +3BaSO4↓
C.氢氧化钠溶液吸收少量SO2气体:SO2 + 2OH-=SO32- + H2O
D.硫酸亚铁加过氧化氢溶液:Fe2+ + H2O2 + 2H+
Fe3+ + 4H2O
难度: 简单查看答案及解析
-
下列根据实验操作和现象所得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
向某溶液中加入盐酸酸化的BaCl2溶液
生成白色沉淀
该溶液中不一定含有SO42—
B
将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水
实验现象1:
上层溶液不变红,
下层溶液紫红色
实验现象2:
上层溶液变红
氧化性:Br2>Fe3+>I2
C
取久置的Na2O2粉末,向其中滴加过量的盐酸
产生无色气体
Na2O2没有变质
D
将一片铝箔置于酒精灯外焰上灼烧
铝箔熔化但不滴落
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al
难度: 简单查看答案及解析
-




A B C D
A. 喷泉实验 B. 实验室制取并收集氨气
C. 制备氢氧化亚铁 D. 验证苯中是否含有碳碳双键
难度: 简单查看答案及解析
-
在200 mL 含Mg2+、Al3+、NH4+、H+、Cl-的溶液中,逐滴加入5 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述不正确的是( )

A.x-y=0. 01 mol
B.原溶液中c(Cl-)=0.75 mol·L-1
C.原溶液的pH=1
D.原溶液中n(Mg2+)∶n(Al3+)=5∶1
难度: 简单查看答案及解析
-
在下列条件下,能大量共存的离子组是( )
A.c(H+)=1×10-14mol/L的溶液: K+、Cu2+、I-、SO42-
B.水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32-
C.能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
D.能与K3[Fe(CN)6]产生蓝色沉淀的溶液:H+、Na+、SO42-、CrO42-
难度: 简单查看答案及解析
-
下列表述正确的是( )
①开发使用新型清洁能源,减少化石燃料的燃烧,可从根本上防止酸雨的产生 ②我国从2000年起逐渐用二氧化氯取代氯气对饮用水进行消毒,因为二氧化氯杀菌、消毒能力强,持效长 ③氧化镁可用来制造耐火砖和坩埚等④明矾能使水中的悬浮物凝聚,可做为净水剂 ⑤建设三峡大坝使用了大量水泥,水泥是硅酸盐材料 ⑥给机动车安装尾气净化器,可减少光化学烟雾的发生
A.①④⑤ B.①②④⑤ C.②③④⑥ D.全部
难度: 中等查看答案及解析
-
向50 mL稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如下图所示,且每一段只对应一个反应。下列说法正确的是( )
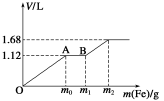
A.开始时产生的气体为H2
B.AB段产生的反应为置换反应
C.所用混合溶液中c(HNO3)=0.5 mol·L-1
D.参加反应铁粉的总质量m2=5.6 g
难度: 困难查看答案及解析
-
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A. ②⑤ B. ②③⑥ C. ①⑤⑥ D. ③⑥
难度: 简单查看答案及解析
-
含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2===2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2===Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2===Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2===2Br2+2Fe3++6Cl-
难度: 简单查看答案及解析
-
下列各组物质中,满足下图物质一步转化关系的选项是 ( )

选项
X
Y
Z
A
Na
NaOH
NaHCO3
B
Cu
CuSO4
Cu(OH)2
C
C
CO
CO2
D
Si
SiO2
H2SiO3
难度: 中等查看答案及解析
-
从矿物学资料查得一定条件下自然界存在如下反应:14CuSO4 + 5FeS2 + 12H2O === 7Cu2S + 5FeSO4 + 12H2SO4,下列说法中正确的是 ( )
A.CuSO4是氧化剂,FeS2是还原剂
B.产物中的SO42-有一部分是氧化产物
C.Cu2S既是氧化产物又是还原产物
D.5 mol FeS2发生反应,有10 mol e-转移
难度: 简单查看答案及解析
-
下列推断合理的是( )
A. 明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
B. 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应
C. 浓H2SO4有强氧化性,不能与Cu发生剧烈反应
D. 将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
难度: 简单查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是 ( )
A.60 mL B.45 mL C.30 mL D.15 mL
难度: 简单查看答案及解析
-
将0.4gNaOH和1.06g
混合并配成溶液,向溶液中滴加0.1mol·
稀盐酸。下列图像能正确表示加入盐酸的体积和生成
的物质的量的关系的是( )
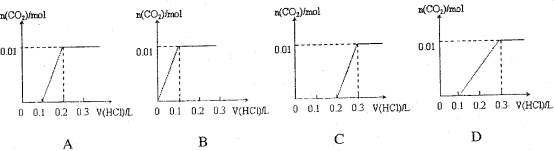
难度: 简单查看答案及解析