-
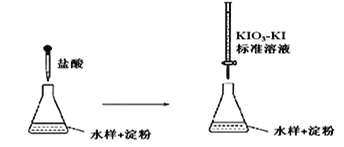
下列实验方案合理且能达到对应目的的是
实验目的
实验方案
A
制备Fe(OH)3胶体
向25 mL沸水中逐滴加入5~6滴饱和FeCl3溶液,加热煮沸至溶液呈红褐色
B
除去乙酸乙酯中的乙酸
向混合物中加入饱和氢氧化钠溶液,充分振落、静置、分液
C
比较HClO、HCN的酸性强弱
用pH试纸测浓度相同的NaClO溶液和NaCN溶液的pH值
D
测定中和反应的反应热
50 mL5.0 mol/L 的盐酸和 50 mL5.0 mol/L 的 NaOH 溶液反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下面的“诗”情“化”意,分析正确的是
A. “粉身碎骨浑不怕,要留清白在人间”只发生了物理变化
B. “日照澄州江雾开”中伴有丁达尔效应
C. 杜康用高粱酿酒的原理,是通过蒸馏法将高梁中的乙醇分离出来
D. “绿蚁新醅酒,红泥小火炉”,“新醅酒”即新酿的酒,在酿酒过程中,葡萄糖发生了水解反应
难度: 简单查看答案及解析
-
下列有关分类的说法正确的是
A. 胶体的本质特征是具有丁达尔效应
B. 阳离子、阴离子中均分别只含有一种元素,则由这样的阴、阳离子组成的物质一定是纯净物
C. 白磷转化为红磷是物理变化
D. 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物
难度: 中等查看答案及解析
-
某化学学习小组讨论辨析以下说法,其中正确的是
①福尔马林、聚苯乙烯、油脂、生铁、铝热剂、肥皂均是混合物 ②冰和干冰都是酸性氧化物,固体时是分子晶体
③小苏打、硬脂酸钠、BaSO4、Al2O3都是强电解质 ④CO2、NH3、SO2、H2S、Cl2都是非电解质 ⑤鸡蛋清溶液、淀粉溶液、烟水晶、雾都是胶体 ⑥苯酚、纯碱、胆矾和H2O2分别属于酸、碱、盐和氧化物
A. ①③⑤ B. ①②④⑤
C. ①②③⑤ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 澄清透明的溶液中:Fe3+、Ba2+、NO3-、Cl-
B. 使酚酞变红色的溶液中:Na+、NH4+、C1-、SO42-
C. c(Al3+)=0.1mol/L的溶液中:K+、Mg2+、SO42-、AlO2-
D. 由水电离产生的c(H+)=10-13mol/L的溶液中:K+、Na+、CH3COO-、NO3-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法错误的是
A. 18g重甲基(-CD3)中含有的电子数为9NA
B. 22.4L(标准状况)CH2Cl2中含C-H键数为2NA
C. 10g34%H2O2溶液与足量的酸性KMnO4溶液充分反应,转移的电子数为0.2NA
D. 0.1mol由乙烯与乙醇组成的混合物完全燃烧所消耗的氧气分子数为0.3NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式为
A. 向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O
B. 酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C. 将等物质的量浓度的氯水与FeI2溶液等体积混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
D. 向氢氧化钡溶液中通入足量的SO2气体 OH-+SO2=HSO3-
难度: 中等查看答案及解析
-
已知:SO32—+I2+H2O===SO42—+2H++2I-,某溶液中可能含有I-、NH4+、Cu2+、SO32—,向该无色溶液中加入少量溴水,溶液仍呈无色,下列判断正确的是( )
A. 肯定不含I- B. 肯定不含NH4+ C. 可能含有SO32— D. 可能含有I-
难度: 困难查看答案及解析
-
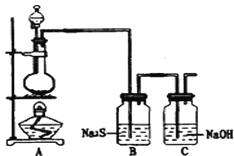
下列装置图能达到相应目的的是
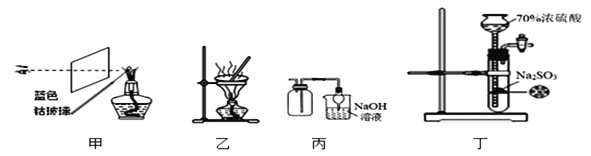
A. 装置甲:检验碳酸钾中钾元素的存在
B. 装置乙:蒸干MgCl2饱和溶液制备MgCl2·6H2O晶体
C. 装置丙:收集NO2并防止其污染环境
D. 装置丁:制备少量SO2
难度: 中等查看答案及解析
-
运载火箭常用偏二甲肼(C2H8N2)(其中N的化合价为-3)作燃料和四氧化二氮(N2O4)反应。在火箭升空过程中,燃料发生反应:C2H8N2+2N2O4
2CO2+3N2+4H2O提供能量。下列有关叙述正确的是
A. 该燃料绿色环保,在燃烧过程中不会造成任何环境污染
B. 该反应中N2O4是氧化剂,偏二甲肼是还原剂
C. N2既是氧化产物又是还原产物,CO2既不是氧化产物也不是还原产物
D. 每有0.6 mol N2生成,转移电子数目为2.4NA
难度: 中等查看答案及解析
-
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小
D. 需要称量NaClO固体的质量为140 g
难度: 中等查看答案及解析
-
从某些反应看,NH3和H2O、NH4+和H3O+、NH
和OH-、N3-和O2-两两类似。据此判断下列反应正确的是
①CaO+2NH4Cl===CaCl2+2NH3↑+H2O ②2Na+2NH3===2NaNH2+H2↑
③3Mg(NH2)2===Mg3N2+4NH3↑ ④NH4Cl+NaNH2===NaCl+2NH3↑
A. 只有③ B. 只有① C. ①和② D. 都正确
难度: 中等查看答案及解析
-
把a L含(NH4)2SO4和NH4NO3的混合液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份与BaCl2溶液完全反应,消耗c mol BaCl2,则原溶液中c(NO3-)为
A.
mol·L-1 B.
mol·L-1
C.
mol·L-1 D.
mol·L-1
难度: 中等查看答案及解析
-
纯净物X、Y、Z转化关系如图所示,下列判断正确的是

A. X可能是金属铜 B. Y不可能是氢气
C. Z可能是三氧化硫 D. Z可能是氯化钠
难度: 中等查看答案及解析
-
燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。下列说法错误的是
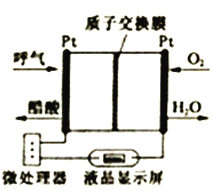
A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. 当电路中有0.4mol电子转移时,消耗3.2gO2
C. 电池工作时H+从右向左通过质子交换膜
D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量
难度: 中等查看答案及解析
-
在浓盐酸中H2AsO3与SnCl2反应的离子方程式为:3SnCl2+12Cl-+2H3AsO3+6H+===2As+3SnCl62-+6M,关于该反应的说法中正确的组合是
①氧化剂是H3AsO3;②还原性:Cl->As;③每生成7.5 g As,还原剂失去的电子为0.3 mol;④M为OH-;⑤SnCl62-是氧化产物
A. ①③ B. ①③⑤ C. ①②③④ D. ①②④⑤
难度: 中等查看答案及解析
-
埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
A. 在含铁元素较多的酸性土壤中 B. 在潮湿疏松的碱性土壤中
C. 在干燥致密不透气的土壤中 D. 在含碳粒较多,潮湿透气的中性土壤中
难度: 简单查看答案及解析
-
下列有关电解质及电解质溶液中微粒浓度关系的说法正确的是
A. 氯化铝是非电解质,不能用电解熔融氯化铝的方法制备铝
B. 将NaOH溶液用水稀释,恢复至原温度,所有离子浓度均减小
C. 0.1 mol·L-1 Na3PO4溶液中:c(Na+)=3c(PO43-)+3c(HPO42-)+3c(H2PO4-)+3c(H3PO4)
D. 含0.3 mol NaOH的溶液吸收0.2 mol CO2后的溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示。下列离子方程式错误的是
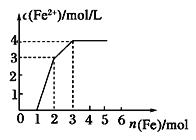
A. 0~1:Fe+NO3-+4H+===Fe3++NO↑+2H2O
B. 1~2:Fe+2Fe3+===3Fe2+
C. 2~3:Fe+Cu2+===Fe2++Cu
D. 0~3:3Fe+2Fe3++2Cu2+===5Fe2++2Cu
难度: 困难查看答案及解析
-
向59.2 g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0 L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0 mol/L的NaOH溶液2.8 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6 g。下列有关说法错误的是
A. Fe2O3与FeO的物质的量之比为1∶6
B. 硝酸的物质的量浓度为3.0 mol/L
C. 产生的NO在标准状况下的体积为4.48 L
D. Fe2O3,FeO与硝酸反应后剩余HNO3为0.2 mol
难度: 困难查看答案及解析
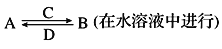

 。
。