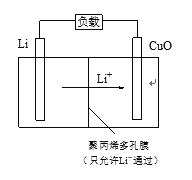
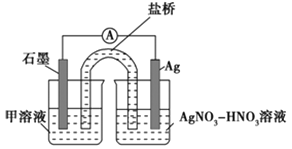
-
下列生活中常见物质的用途与其还原性有关的是
A. 碘酒中的
碘
B. 暖宝宝中的
铁粉
C. 抗酸药中的
氢氧化铝
D. 尿不湿中的
聚丙烯酸钠




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列事实与水解反应无关的是
A. 用Na2S除去废水中的Hg2+ B. 用热的Na2CO3溶液去油污
C. 利用油脂的皂化反应制造肥皂 D. 配制CuSO4溶液时加少量稀H2SO4
难度: 中等查看答案及解析
-
完成下列实验,所选装置正确的是( )
A
B
C
D
实验
目的
实验室
制备乙烯
分离苯和溴苯的混合物(沸点:苯为80.1℃,溴苯为156.2℃)
分离KCl和NH4Cl固体混合物
实验室用纯碱和稀硫酸制备二氧化碳
实验
装置




A. A B. B C. C D. D
难度: 简单查看答案及解析
-
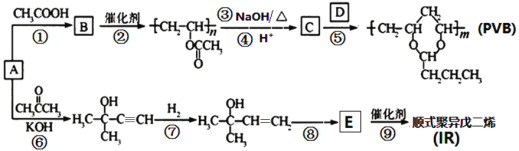
已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
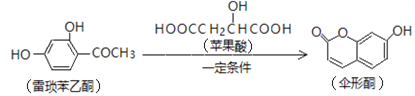
下列说法中正确的是
A. 一分子雷琐苯乙酮含有3个碳碳双键
B. 苹果酸的一种缩聚产物是
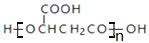
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
已知:2SO2 (g)+ O2(g)
2SO3(g) ΔH,有关数据如下:
T(℃)
527
627
727
827
927
平衡常数K
910
42
3.2
0.39
0.12
下列说法不正确的是
A. 根据平衡常数随温度的变化关系,判断出ΔH<0
B. 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃)
C. 增大压强、降低温度能提高SO2的转化率
D. SO3的稳定性随温度的升高而降低
难度: 中等查看答案及解析
-
混合动力汽车(HEV) 中使用了镍氢电池,其工作原理如图所示:其中M 为储氢合金,MH 为吸附了氢原子的储氢合金,KOH 溶液作电解液。关于镍氢电池,下列说法不正确的是

A. 充电时,阴极附近pH 降低
B. 电动机工作时溶液中OH-向甲移动
C. 放电时正极反应式为:NiOOH+H2O+e- =Ni(OH)2+OH-
D. 电极总反应式为:MH+NiOOH
M+Ni(OH)2
难度: 中等查看答案及解析
-
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中c(SO32-)/c(Fe3+)变化的曲线如图所示。实验发现:

i. a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色;
ii. c点和d点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色。下列分析合理的是
A. 向a点溶液中滴加BaCl2溶液,无明显现象
B. b点较a点溶液pH升高的主要原因:2Fe3+ + SO32- + H2O === 2Fe2+ + SO42- + 2H+
C. c点溶液中发生的主要反应:2Fe3+ + 3SO32- + 6H2O
2Fe(OH)3↓+ 3H2SO3
D. 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深
难度: 中等查看答案及解析