-
《本草纲目》记载到:慈石治肾家诸病,而通耳明目。慈石,色轻紫,石上皲涩,可吸连针铁,俗谓之熁铁石。“慈石”的主要成分是( )
A. 铁 B. 氧化铜 C. 氧化铁 D. 四氧化三铁
难度: 简单查看答案及解析
-
下列有关金属的工业制法中,错误的是
A.制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠
B.制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁
C.制硅:用焦炭还原二氧化硅得硅
D.制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁
难度: 中等查看答案及解析
-
既能跟强酸反应又能跟强碱反应的正盐是:( )
A. NaHCO3 B. Al(OH)3 C. Na2SO4 D. (NH4)2SO3
难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段.下列分类结论说法正确个数为( )
①氨水、氢氧化铝、冰醋酸、氟化氢都是弱电解质
②HClO、浓硫酸、HNO3均具有强氧化性,都是氧化性酸
③HI、CH3COOH、胆矾、氯气都是电解质
④NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物
⑤漂粉精、福尔马林、水玻璃、水银都是混合物
⑥青铜、硬铝、不锈钢和目前流通的硬币都是合金
⑦C60、C70、金刚石、石墨都是碳的同素异形体.
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
N2O俗称“笑气”,曾用作可吸入性麻醉剂。以下反应能产生N2O:3CO+2NO2
3CO2+N2O。下列关于N2O的说法正确的是( )
A. 上述反应中每生成1 mol N2O,转移的电子数为3NA
B. 等物质的量的N2O和CO2含有相等的电子数
C. N2O只具有氧化性,无还原性
D. N2O会迅速与人体血红蛋白结合,使人中毒
难度: 中等查看答案及解析
-
向铝土矿(含A12O3、FeO、Fe2O3、SiO2)中加入适量硫酸溶液,分别取浸取液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是 ( )
A. 通入过量SO2:H+、Fe2+、Al3+、SO42-
B. 通入过量氨气:NH4+、[A1OH]4-、OH-、SO42-
C. 加入过量NaC1O溶液:Fe3+、Na+、ClO-、SO42-
D. 加入过量NaOH溶液:Na+、[A1OH]4-、OH-、SO42-、SiO32-
难度: 中等查看答案及解析
-
下列实验方案中,不能达到实验目的的是( )
选项
实验目的
实验方案
A
鉴别溴蒸气和NO2
分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽
B
证明氧化性:H2O2比Fe3+强
用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色
C
证明盐类水解是吸热反应
在醋酸钠溶液中滴入酚酞试液,加热后红色加深
D
证明难溶物存在沉淀溶解平衡
往黄色固体难溶物PbI2中加水振荡,静置取上层清液加入NaI固体产生黄色沉淀
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
建构数学模型来研究化学问题,既直观又简洁。下列建构的数轴模型正确的是
A. 钠在氧气中燃烧,钠的氧化产物:
B. 铁在Cl2中燃烧,铁的氧化产物:
C. NH3与Cl2反应,反应产物:
D. FeBr2溶液中通入Cl2,铁元素存在形式:
难度: 中等查看答案及解析
-
某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中不正确的是( )
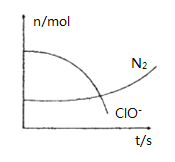
A. 还原剂是含CN-的物质,氧化产物只有N2
B. 氧化剂是ClO-,HCO3-是氧化产物
C. 参与反应的氧化剂与还原剂的物质的量之比为5:2
D. 标准状况下若生成2.24LN2,则转移电子1mol
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是:( )
A. 碳酸钠溶液中滴入少量盐酸:2H++CO32-=H2O + CO2 ↑
B. 硫酸铝溶液中加入过量氨水: Al3+ + 4OH-=AlO2- + H2O
C. 碳酸氢钠溶液中滴入少量氢氧化钡溶液:2HCO3- + Ba2+ + 2OH-==BaCO3↓+CO32- +2H2O
D. FeS溶于稀硝酸:FeS +2H+=H2S↑+Fe2+
难度: 简单查看答案及解析
-
A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C元素的最高价氧化物的水化物是一种中强碱。甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005mol/L戊溶液的pH=2 ,它们之间的转化关系如下图所示(部分反应物省略),下列叙述正确的是( )
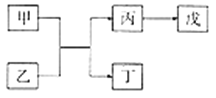
A. C、D两元素形成化合物属共价化合物
B. A、D分别与B元素形成的化合物都是大气污染物
C. C、D的简单离子均能促进水的电离
D. E的氧化物水化物的酸性大于D的氧化物水化物的酸性
难度: 中等查看答案及解析
-
下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去)。当X是强碱时, B能使湿润的红色石蕊试纸变蓝。下列说法中不正确的是
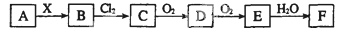
A. 当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B. 当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C. B和Cl2的反应是氧化还原反应
D. 当X是强酸时,C在常温下是气态单质
难度: 中等查看答案及解析
-
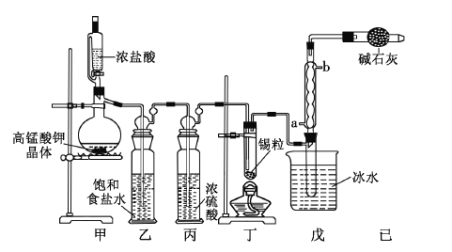
实验室按如下装置测定纯碱(含少量NaC1)的纯度。下列说法不正确的是
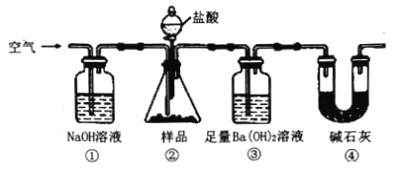
A. 滴入盐酸前,应将装置中含有CO2的空气排尽
B. 装置①、④的作用是防止空气中的CO2进入装置③
C. 必须在装置②、③间添加盛有饱和 NaHCO3溶液的洗气瓶
D. 反应结束时,应再通入空气将装置②中CO2转移到装置③中
难度: 中等查看答案及解析
-
(题文)向一定量Fe和Fe2O3的混合物中加入120mL一定浓度的稀硝酸恰好使混合物溶解,同时可得到标准状况下1.344L NO气体.向所得到的溶液中再加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,得到11.76g铁单质.则原稀硝酸的物质的量浓度为( )
A. 2mol•L-1 B. 4mol•L-1
C. 5.75mol•L-1 D. 无法计算
难度: 中等查看答案及解析
-
I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+
S↓+2I2+2H2O ii.I2+2H2O+SO2
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
试剂组成
0.4 mol·L-1 KI
a mol·L-1 KI
0.2 mol·L-1 H2SO4
0.2 mol·L-1 H2SO4
0.2 mol·L-1 KI
0.0002 mol I2
实验现象
溶液变黄,一段时间后出现浑浊
溶液变黄,出现浑浊较A快
无明显现象
溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I−是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快
难度: 中等查看答案及解析

 。
。