-
下列叙述中,不能用勒夏特列原理解释的是( )
A. 红棕色的NO2,加压后颜色先变深后变浅
B. 高压比常压有利于合成SO3的反应
C. 加入催化剂有利于氨的合成
D. 工业制取金属钾Na(l)+KCl(l)
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
难度: 中等查看答案及解析
-
下列反应在任何温度下均能自发进行的是( )
A. 2N2(g)+O2(g)═2N2O(g)△H=+163 kJ⋅mol−1 B. Ag(s)+1/2Cl2(g)═2AgCl(s)△H=−127 kJ⋅mol−1 C. 2HgO(s)═2Hg(l)+O2(g)△H=+91 kJ⋅mol−1 D. 2H2O2(l)═O2(g)+2H2O(l)△H=−98 kJ⋅mol−1
难度: 中等查看答案及解析
-
在以下各种情形下, 下列电离方程式的书写正确的是( )
A. 熔融状态下的NaHSO4电离:NaHSO4
Na++H++SO42-
B. H2CO3的电离:H2CO3
2H++CO32-
C. Fe(OH)3的电离:Fe(OH)3
Fe3++3OH-
D. 水溶液中NaHSO4的电离:NaHSO4
Na++HSO4-
难度: 中等查看答案及解析
-
下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32—、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3—、Mg2+、Na+、SO42—
C. 在
=1×1012的溶液中:NH4+、Fe2+、Cl-、NO3—
D.
=10-14mol·L-1的溶液中:Na+、HCO3—、Cl-、K+
难度: 中等查看答案及解析
-
H2S2O3是一种弱酸,实验室欲用0.01 mol/L的Na2S2O3溶液滴定碘水,发生的反应为I2+2Na2S2O3===2NaI+Na2S4O6,下列说法正确的是( )
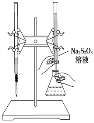
A. 该滴定反应可用甲基橙作指示剂
B. Na2S2O3是该反应的还原剂
C. 该滴定反应可选用如下图所示的装置
D. 该反应中每消耗2 mol Na2S2O3,转移电子的物质的量为4 mol
难度: 中等查看答案及解析
-
常温下,关于溶液的稀释,下列说法正确的是( )
A. pH=3的醋酸溶液稀释100倍,pH=5
B. pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C. 将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2 L,pH=13
D. pH=8的NaOH溶液稀释100倍,其pH=6
难度: 中等查看答案及解析
-
在一定温度下的可逆反应:mA(g)+nB(g)
pC(g)+qD(g),生成物C的体积分数与压强p1和p2、时间t1和t2的关系如图所示,则下列关系正确的是( )
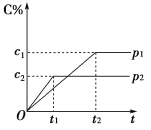
①p1>p2 ②p1<p2 ③m+n>p+q ④m+n=p+q ⑤m+n<p+q
A. ①③ B. ②③ C. ②⑤ D. ①④
难度: 中等查看答案及解析