-
下列现象与胶体的性质无关的是
A. 河流入海口处易形成三角洲
B. 将盐卤或石膏加入豆浆,制成豆腐
C. 向 FeCl3 溶液中加入 NaOH 溶液,会出现红褐色沉淀
D. 清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象
难度: 简单查看答案及解析
-
为了检验某FeCl2溶液是否变质,应选用的试剂是
A. NaOH溶液 B. KSCN溶液 C. 铁片 D. 石蕊试液
难度: 简单查看答案及解析
-
提纯下列物质(括号内为少量杂质),所选用的除杂试剂与分离方法错误的是( )
不纯物质
除杂试剂
分离方法
A
Mg(Al)
NaOH溶液
过滤
B
乙烷(乙烯)
溴水
洗气
C
CuCl2(FeCl3)
单质铜
过滤
D
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 用灼烧的方法鉴别羊毛线和棉线 B. 光导纤维的主要成分是二氧化硅
C. 铁红是Fe2O3可为红色涂料主要成份 D. 中和胃酸过多可用Na2CO3、Al(OH)3
难度: 简单查看答案及解析
-
下列物质的分类组合不正确的有( )
①海水、空气、胆矾、盐酸均为混合物;
②H2CO3、CH3COOH、H2SO4、H2S均为酸;
③Mg(OH)2、NaOH、Cu2(OH)2CO3、NH3•H2O均为碱;
④干冰、N2O5、SiO2、H2O均为酸性氧化物;
⑤NaHSO4、AgCl、AlCl3、CaCO3均为盐;
⑥NaH2PO4、Na2SO4、纯碱既为钠盐,同时又为含氧酸盐。A. ①③④⑥ B. ①③④ C. ①②③⑤⑥ D. ⑤⑥
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 11.2 L H2中含有氢原子的个数为NA
B. 在标准状况下,22.4 LCO2中含有共用电子对数为4NA
C. 78gNa2O2与少量CO2反应转移电子数为NA
D. 1 mol/L NaCl溶液中含有钠离子的个数为NA
难度: 中等查看答案及解析
-
在含有I一且能使酚酞变红的无色溶液中,可大量存在的离子组是( )
A. Na+、Cu2+、Br一、Cl- B. AlO2-、K+、NH4+、Na+
C. K+、Na+、NO3-、H+ D. K+、S2-、SO42-、OH-
难度: 简单查看答案及解析
-
能正确表示下列反应的离子反应方程式为( )
A. Ba(OH)2溶液中加入少量NaHCO3溶液:HCO3-+Ba2++OH-=BaCO3
+H2O
B. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:3Ba2++3SO42-+2Al3++6OH-═2BaSO4↓+2Al(OH)3↓
C. NH4HCO3稀溶液与过量的KOH溶液反应:HCO3-+OH-=CO32-+H2O
D. 醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
下列各组物质,前者滴加到后者中直至过量,先出现白色沉淀,后来沉淀消失的是( )
A. HCl滴入NaAlO2溶液中 B. Ba(OH)2溶液滴入Al2(SO4)3溶液中
C. AlCl3溶液滴入NaOH溶液中 D. 氨水滴入AlCl3溶液中
难度: 困难查看答案及解析
-
有时候,将氧化还原方程式拆开写成两个“半反应”。下面是一个“半反应”式:( )NO3— +( )H++( )e-=( )NO+( )H2O,该式的配平系数是( )
A. 1,3,4,2,1 B. 2,4,3,2,1 C. 1,6,5,1,3 D. 1,4,3,1,2
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A. 相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B. 同体积、同密度的C2H4和CO,两种气体的分子数一定相等
C. 配制450mL0.1mol/L的NaOH溶液,用托盘天平称取NaOH固体1.8g
D. 1L0.45mol/LNaCl溶液中Cl-物质的量浓度比0.1L0.15mol/LAlCl3溶液大
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是( )
实验
现象
结论
A.
向2mL0.1mol/LFeCl3的溶液中加足量铁粉,振荡,加1滴KSCN溶液
黄色逐渐消失,加KSCN溶液颜色不变
还原性:Fe>Fe2+
B.
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C.
将碳酸氢钠分解产生的气体通入CaCl2溶液
产生白色沉淀
CO2与CaCl2溶液反应
D.
将0.1mol/LMgSO4溶液滴入NaOH溶液至不在有沉淀产生,再滴加0.1mol/LCuSO4溶液
先有白色沉淀生成后变为浅色蓝色沉淀
Mg(OH)2的溶度积(Ksp)比Cu(OH)2大
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
以下物质间的每步转化通过一步反应能实现的是( )
A. Al-Al2O3-Al(OH)3-NaAlO2 B. Si-SiO2-H2SiO3-Na2SiO3
C. Cu-CuO-Cu(OH)2-CuSO4 D. Na-Na2O2-Na2CO3-NaOH
难度: 中等查看答案及解析
-
由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是( )
A. 26:8:1 B. 22:1:14 C. 13:8:7 D. 26:6:17
难度: 中等查看答案及解析
-
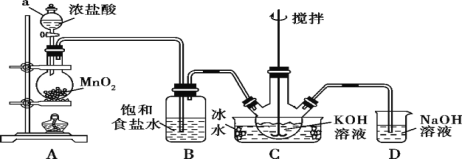
下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
难度: 简单查看答案及解析
-
在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12L,则混合气体中NO的体积为( )
A. 112mL B. 1008mL C. 224mL D. 448mL
难度: 简单查看答案及解析
-
某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列方框中对应的物质或有关叙述正确的是( )
A. Na2S4O6、H2O、Na2S2O3、Au2O、NaOH B. Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C. Na2S2O3、H2O、Na2S4O6、Au2O、NaOH D. 当1 mol Au2O3完全反应时,转移电子8mol
难度: 中等查看答案及解析
-
两份体积相同,浓度未知的Na2CO3和HCl溶液,将它们互相滴加,产生的气体在相同的温度和压强下的体积比为1:3,则Na2CO3和HCl溶液的浓度之比为( )
A. 5:6 B. 2:5 C. 3:4 D. 5:3
难度: 中等查看答案及解析
-
以下实验操作可能会导致实验结果偏高的是( )
A. 配制一定物质的量浓度的溶液:移液后未洗涤烧杯
B. 配制一定物质的量浓度的溶液:定容时仰视刻度线
C. 配制一定物质的量浓度稀硫酸时:用量筒量取浓硫酸时俯视读数
D. 用浓硫酸与烧碱的稀溶液反应来测定中和热的数值
难度: 简单查看答案及解析
-
在200mL含Mg2+、Al3+、NH4+、H+、Cl—等离子的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示。下列叙述正确的是( )

A. 原溶液中n(Mg2+):n(Al3+)=10:1 B. 原溶液中的c(H+)=0.02mol/L
C. x与y的差值为0.008mol D. 原溶液中c(Cl-)=0.6mol/L
难度: 中等查看答案及解析
-
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )

A. Na+、Fe3+、K+、ClO—都可在该物质的溶液中大量共存
B. 该物质可以用于氧化还原滴定测定K2Cr2O7含量
C. 向0.1mol/L该物质的溶液中逐滴滴加0.1mol/LNaOH溶液,生成沉淀的物质的量与加入NaOH溶液体积的关系如右图所示
D. 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42—完全沉淀的离子方程式为:Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
难度: 中等查看答案及解析
-
某磁黄铁矿的主要成分是FexS(S为一2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g、FeCl20.425 mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是( )
A. 100 mL的盐酸中HC1物质的量浓度为8.5 mol/L
B. 生成的H2S气体在标准状况下的体积为5.6L
C. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3 : 1
D. 该磁黄铁矿中FexS的x=0.15
难度: 中等查看答案及解析
-
向0.6molFeBr2溶液中通入amolCl2。下列叙述不正确的是( )
A. 当a=0.2时,发生的反应为:2Fe2++Cl2=2Fe3++2Cl-
B. 当a=0.9时,发生的反应为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C. 若溶液中Br- 有一半被氧化时,c(Fe3+):c(Br-):c(Cl-)=l:1:3
D. 当0<a<0.3时,溶液中始终满足2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
难度: 中等查看答案及解析