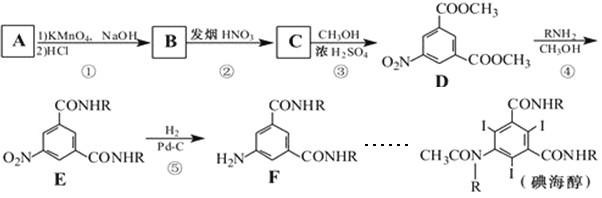
-
O2F2可以发生反应:H2S+4O2F2→SF6+2HF+4O2,下列说法正确的是( )
A. 氧气是氧化产物
B. O2F2既是氧化剂又是还原剂
C. 若生成4.48 L HF,则转移0.8 mol电子
D. 还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
下列反应可用离子方程式“H++OH−=H2O”表示的是( )
A. NaHSO4溶液与Ba(OH)2溶液混合 B. NH4Cl溶液与Ca(OH) 2溶液混合
C. HNO3溶液与KOH溶液混合 D. Na2HPO4溶液与NaOH溶液混合
难度: 中等查看答案及解析
-
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A. 通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B. 加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C. 加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D. 加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
难度: 困难查看答案及解析
-
下列关于化学用语的表示正确的是( )
A. 过氧化钠的电子式:
B. 次氯酸分子的结构式:H﹣Cl﹣O
C. C60和石墨互为同位素 D. 具有10个中子的氧原子:
难度: 简单查看答案及解析
-
下列化工生产过程中,未涉及氧化还原反应的是( )
A. 海带提碘 B. 氯碱工业 C. 海水淡化 D. 海水提溴
难度: 简单查看答案及解析
-
下列各组物质的熔点均与所含化学键的键能有关的是
A. CaO与CO2 B. NaCl与HCl C. SiC与SiO2 D. Cl2与I2
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 将铜插入稀硝酸中:Cu+4H++2NO3 -=Cu2++2NO2↑+H2O
B. 向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe3+
C. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+3Na+
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A. SiO2
SiCl4
Si
B. FeS2
SO2
H2SO4
C. N2
NH3
NH4Cl(aq)
D. MgCO3
MgCl2(aq)
Mg
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. SO2具有氧化性,可用于漂白纸浆 B. NH4HCO3受热易分解,可用作氮肥
C. Fe2(SO4)3易溶于水,可用作净水剂 D. Al2O3熔点高,可用作耐高温材料
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
难度: 中等查看答案及解析
-
[2016全国Ⅰ]下列实验操作能达到实验目的的是
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释
D. 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
难度: 中等查看答案及解析
-
向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
A. c(CO32-) B. c(Mg2+) C. c(H+) D. Ksp(MgCO3)
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 氢氧燃料电池工作时,H2在负极上失去电子
B. 0.1mol/L碳酸钠溶液加热后,溶液的pH减小
C. 常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D. 室温下,稀释0.1mol/L醋酸溶液,溶液的导电能力增强
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是
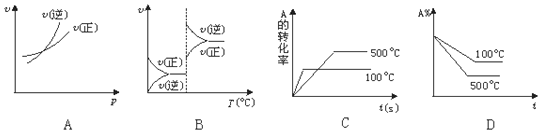
难度: 困难查看答案及解析
-
向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项
n(CO2)/mol
溶液中离子的物质的量浓度
A
0
c(Na+)>c(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)> c(OH-)>c(CO32-)
C
0.015
c(Na+)> c(HCO3-)>c(CO32-)> c(OH-)
D
0.03
c(Na+)> c(HCO3-)> c(OH-)>c(H+)
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是( )
A. 向0.1mol/LCH3COOH溶液中加入少量水,溶液中
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中
增大
C. 向盐酸中加入氨水至中性,溶液中
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
-
两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:

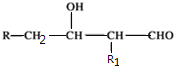
若两种不同的醛,例如乙醛(CH3CHO)与丙醛(CH3CH2CHO)在NaOH溶液中最多可以形成羟基醛有
A.1种 B.2种 C.3种 D.4种
难度: 困难查看答案及解析