-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
下列关于电解质的说法正确的是
A. 强电解质溶液的导电性一定比弱电解质溶液的导电性强
B. 强电解质都是离子化合物,而弱电解质都是共价化合物
C. 强电解质在稀的水溶液中全部以离子的形态存在
D. 水溶液中导电能力差的电解质一定是弱电解质
难度: 中等查看答案及解析
-
下列叙述,正确的是( )
A. 液态HCl、固态NaCl均不导电,所以HCl和NaCl均为非电解质
B. NH3、SO3的水溶液均导电,所以NH3、SO3是电解质
C. 铜丝、石墨均导电,所以它们是电解质
D. 蔗糖、酒精在水溶液中或熔融时均不导电,所以它们是非电解质
难度: 中等查看答案及解析
-
下列变化为放热的化学反应的是( )
A. H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
B. 2HI(g)===H2(g)+I2(g) ΔH=+14.9 kJ·mol-1
C. 形成化学键时共放出862 kJ能量的化学反应
D. 能量变化如下图所示的化学反应

难度: 中等查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O===O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
难度: 简单查看答案及解析
-
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
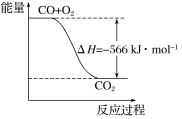
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
下列叙述中一定能判断某化学平衡发生移动的是( )
A. 混合物中各组分的浓度改变 B. 正、逆反应速率改变
C. 混合物中各组分的含量改变 D. 混合体系的压强发生改变
难度: 中等查看答案及解析
-
对可逆反应4NH3(g)+ 5O2(g)
4NO(g)+ 6H2O(g),下列叙述正确的是
A. 达到化学平衡时,4υ正(O2)= 5υ逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
D. 化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
难度: 中等查看答案及解析
-
在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
难度: 简单查看答案及解析
-
将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)
2Z(g) ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
难度: 中等查看答案及解析
-
已知甲为恒温、恒压容器,乙为恒温、恒容容器。两容器中均充入1 mol N2、3 mol H2,初始时两容器的温度、体积相同。一段时间后反应达到平衡,为使两容器中的N2在平衡混合物中的物质的量分数相同,下列措施中可行的是
A. 向甲容器中充入一定量的氦气
B. 向乙容器中充入一定量的N2
C. 升高乙容器的温度
D. 增大甲容器的压强
难度: 中等查看答案及解析
-
在一密闭容器中,反应mA(g)
nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则
A. 平衡向逆反应方向移动了 B. 物质A的转化率增大
C. 物质C的质量分数增大 D. m > 2n
难度: 中等查看答案及解析
-
已知相同条件下,HClO的电离常数小于H2CO3的第一级电离常数。为了提高氯水中HClO的浓度,可加入
A. HCl B. CaCO3(s) C. H2O D. NaOH(s)
难度: 中等查看答案及解析
-
已知反应mX(g)+nY(g)
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,Y的转化率降低
难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是:
A. 反应达到平衡时,X的转化率为50% B. 反应可表示为X+3Y
2Z,其平衡常数为1600 C. 增大压强使平衡向生成Z的方向移动,平衡常数增大 D. 改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
加热N2O5时,发生以下两个分解反应:N2O5
N2O3+O2,N2O3
N2O+O2,在1 L密闭容器中加入4 mol N2O5达到化学平衡时c(O2)为4.50 mol/L,c(N2O3)为1.62 mol/L,则在该温度下各物质的平衡浓度正确的是( )
A. c(N2O5)=1.44 mol/L B. c(N2O5)=0.94 mol/L
C. c(N2O)=1.40 mol/L D. c(N2O)=3.48 mol/L
难度: 中等查看答案及解析
-
在36 g 碳不完全燃烧所得气体中,CO占1/3体积,CO2占2/3体积,且C(s) +1/2O2(g) = CO(g) △H = -110.5 kJ/mol;CO(g) +1/2O2(g) = CO2(g) △H = -283 kJ/mol.与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1149 kJ C. 517.5 kJ D. 283kJ
难度: 中等查看答案及解析
-
(题文)用CH4催化还原NOx,可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH=-1 160 kJ·mol-1
下列说法不正确的是( )
A. 若用标准状况下4.48 L CH4还原NO2生成N2和水蒸气,放出的热量为173.4 kJ
B. 由反应①可推知:CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(l) ΔH<-574 kJ·mol-1
C. 反应①②转移的电子数相同
D. 反应②中当4.48 L CH4反应完全时转移的电子总数为1.60 mol
难度: 困难查看答案及解析
-
已知3.6 g碳在6.4 g氧气中燃烧,至反应物耗尽,测得放出热量a kJ。又知12.0 g碳完全燃烧,放出热量为 b kJ。则热化学方程式C(s)+1/2O2(g)===CO(g) ΔH=Q,其中Q等于( )
A. -(a-b) kJ·mol-1 B. -(a+b) kJ·mol-1
C. -(5a-0.5b) kJ·mol-1 D. -(10a-b) kJ·mol-1
难度: 简单查看答案及解析



