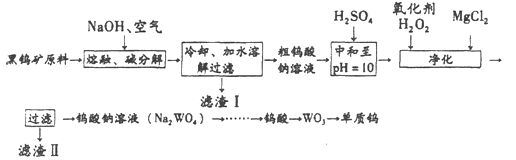
-
化学与生产、生活密切相关。下列叙述中正确的是
A. 木糖醇(CH2OH(CHOH)3CH2OH)可作糖尿病人的甜味剂,属于糖类
B. 2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
C. 卤水煮豆腐是Mg2+、Ca2+等使蛋白质变性的过程
D. 维生素C具有还原性,食品中添加维生素C既作营养强化剂又作抗氧化剂
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是
A. 向1L0.3mol/L NaOH溶液中通入0.2molCO2,溶液中CO32- 和HCO3- 的数目均为0.1NA
B. 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA
C. 1mol FeI2与足量氯气反应时转移的电子数为3NA
D. 100g质量分数为46%的乙醇溶液中所含的氢原子数为6NA
难度: 中等查看答案及解析
-
下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
选项
实验操作
现象
结论
A
向某无色溶液中先加入氯化钡溶液,再加入足量盐酸
生成白色沉淀,沉淀不溶解。
该溶液中有SO42-
B
用坩埚钳夹住点燃的镁条伸入二氧化碳气体中
镁条剧烈燃烧
二氧化碳作还原剂
C
将二氧化硫气体通人Ba(NO3)2溶液中
有白色沉淀生成
H2SO3与Ba(NO3)2发生复分解反应生成BaSO3
D
向盛有1mLO.lmolFeBr2溶液的试管中滴入几滴KSCN溶液和1 mL苯,然后加入几滴氯水,并缓缓振荡
下层溶液变红,上层溶液无明显变化
还原性:Fe2+>Br-
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
利用石墨电极电解1mol/L氯化钠溶液,并收集阳极气体检验其成分。已知:O2能使酸性的淀粉KI溶液变蓝,不能使中性的淀粉KI溶液变蓝。
实验:①将气体通入中性的淀粉KI溶液中,溶液变蓝。②用足量NaOH溶液充分洗气,气体体积减少,将剩余气体通入中性的淀粉KI溶液中,溶液颜色不变,再向溶液中滴加2滴H2SO4溶液,溶液变蓝。③向酸性的淀粉KI溶液中通入空气,溶液颜色不变。
下列对实验现象的解释或推测不合理的是
A. 根据实验现象可以判断电解时阳极的电极反应式为:2Cl-—2e-Cl2↑
B. 根据实验可以得出反应物的浓度和溶液的pH会影响物质的氧化性
C. 根据实验可以得出中性条件下,氧化性Cl2>O2
D. NaOH溶液洗气时发生反应的离子方程式为:2OH-+Cl2Cl-+ClO-+H2O
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、R的原子序数依次增大,Y原子达到稳定结构获得的电子数目和它的内层电子数目相等,X与Z同主族,Z是所在周期主族元素中原子半径最大的元素,W的最外层电子数与电子层数相同,R与Z形成的化合物其水溶液呈碱性。下列说法正确的是
A. 离子半径由大到小的顺序为R、Z、W、Y
B. X、Y分别与Z形成的化合物中可以存在非极性共价键
C. 由X、Y、Z、R四种元素形成的两种化合物在水中不能发生反应
D. Z、W、R最高价氧化物对应的水合物两两之间发生反应的生成物均能发生水解
难度: 中等查看答案及解析
-
已知伞形酮可用雷琐苯乙酮和苹果酸在一定条件下反应制得。
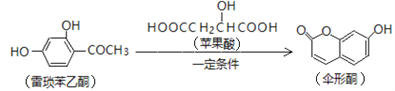
下列说法中正确的是
A. 1mol雷琐苯乙酮最多能与3mol Br2发生取代反应
B. 苹果酸能形成一种缩聚产物是
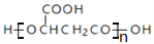
C. 1mol伞形酮与足量NaOH溶液反应,最多可消耗2mol NaOH
D. 雷琐苯乙酮、苹果酸、伞形酮都能跟FeCl3溶液发生显色反应
难度: 中等查看答案及解析
-
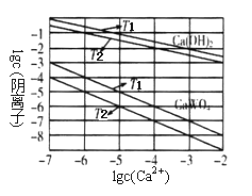
常温下,用浓度为0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的两种一元碱MOH、ROH溶液中,pH随盐酸溶液体积的变化如图所示。下列说法正确的是
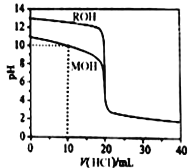
A. pH=10时,溶液中微粒浓度的关系是:c(M+)> c(Cl-)> c(MOH) >c(OH-)>c(H+)
B. 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时,溶液中离子浓度一直保持的关系是:c(R+)>c(M+)>c(OH-)>c(H+)
C. 10mL<V(HCl)<20mL时,溶液中微粒浓度的关系是:c(M+)+c(MOH)<c(Cl-)
D. V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-)
难度: 中等查看答案及解析