-
已知两个热化学方程式: C(s)+O2(g) =CO2(g) ΔH=―393.5kJ/mol
2H2(g)+O2(g) =2H2O(g) ΔH=―483.6kJ/mol
现有炭粉和H2组成的悬浮气共0.2mol,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是( )
A. 1︰1 B. 1︰2 C. 2︰3 D. 3︰2
难度: 困难查看答案及解析
-
已知25℃、101kPa时:
4Al(s)+3O2(g)=2Al2O3(s) △H =-2835kJ·mol-1
4Al(s)+2O3(g)=2Al2O3(s)△H =-3119kJ·mol-1
下列说法正确的是:( )
A. O3比O2稳定,由O2转化为O3是吸热反应
B. O2比O3稳定,由O2转化为O3是放热反应
C. 等质量的O2比O3能量高,由O2转化为O3是放热反应
D. 等质量的O2比O3能量低,由O2转化为O3是吸热反应
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 由能量判据和熵判据组合而成的复合判据,将更适合所有的过程
B. 需要加热才能发生的反应不一定是吸热反应
C. 同一物质的固液气三种状态熵值相同
D. 反应物和生成物所具有的总能量决定了反应是放热还是吸热
难度: 简单查看答案及解析
-
同种规格的铝在相同条件下,分别与下列物质混合,化学反应速率最大的是( )
A. 0.1mol/L盐酸15毫升 B. 0.2 mol/L盐酸12毫升
C. 0.15 mol/L硫酸8毫升 D. 18 mol/L浓硫酸15毫升
难度: 简单查看答案及解析
-
如图所示,在锥形瓶放置有装有水的小试管A,往小试管中分别加入下列物质时:①烧碱固体 ②浓硫酸 ③硝酸铵固体 ④NaCl固体,其中能使a端液面高于b端液面的是( )
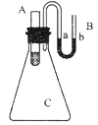
A. ①② B. ③ C. ④ D. ①③
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 增大压强,活化分子百分数增大,反应速率一定增大。
B. 增大反应物浓度,活化分子百分数增大,反应速率一定增大。
C. 降低温度,活化分子百分数增大,反应速率一定增大。
D. 使用催化剂活化分子百分数增大,反应速率一定增大。
难度: 简单查看答案及解析
-
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:N2(g)+2O2(g)====N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g) ====N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是( )
A. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-542.7" kJ·mol-1
B. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 059.3 kJ·mol-1
C. N2H4(g)+1/2 N2O4(g) ====3/2N2(g)+2H2O(g)ΔH="-1" 076.7 kJ·mol-1
D. 2N2H4(g)+N2O4(g) ====3N2(g)+4H2O(g)ΔH="-1" 076.7kJ·mol-1
难度: 中等查看答案及解析
-
对CO2(g)
CO2(aq)△H=-19.75kJ/mol为减少温室效应产生,增大CO2在水中溶解,应采用
A. 升温加压 B. 降温减压 C. 升温减压 D. 降温加压
难度: 简单查看答案及解析
-
下列热化学方程式书写正确的是
A. 2NO2=2NO+O2△H=-184.6kJ/mol(反应热)
B. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=57.3kJ/mol(中和热)
C. C(s)+1/2O2(g)=CO(g)△H=-184.6kJ/mol(燃烧热)
D. S(s)+O2(g)=SO2(g)△H=-184.6kJ/mol(燃烧热)
难度: 简单查看答案及解析
-
对可逆反应A(g)+2B(g)
3C(g)的叙述中能说明已达到平衡的是( )。
A. 混合气体的总物质的量不再变化。 B. 混合气体的总质量不再变化。
C. 容器内的压强不再变化。 D. 某一物质的物质的量不再变化。
难度: 简单查看答案及解析
-
在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
4
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
难度: 简单查看答案及解析
-
已知图一表示的是可逆反应CO(g)+H2(g)
C(s)+H20(g) △H >0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
N2O4(g) △H<0 的浓度(c)随时间t的变化情况。下列说法中正确的是( )
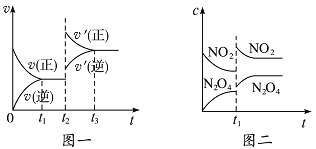
A. 图一t2时改变的条件可能是升高了温度或增大了压强
B. 若图一t2时改变的条件是增大压强,则反应的△H增大
C. 图二t1时改变的条件可能是升高了温度或增大了压强
D. 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小
难度: 困难查看答案及解析
-
对于反应2A(g)+B(g)
2C(g)(正反应放热),下列图象正确的是
A.
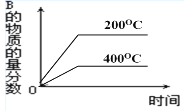 B.
B.  C.
C.  D.
D. 
难度: 简单查看答案及解析
-
在某温度下,可逆反应mA(g) + nB(g)
pC(g) + qD(g)的平衡常数为K,下列说法正确的是( )
A. K值越小,达到平衡时,反应物的转化率越大
B. K值越大,达到平衡时,生成物的含量越大
C. 反应物的转化率越大,达到平衡时,K值越大
D. 温度越高,达到平衡时,K值越大
难度: 简单查看答案及解析
-
在相同温度下,有相同体积的甲、乙两容器,甲容器中充入1g N2和1g H2,乙容器中充入2g N2和2g H2。下列叙述中,错误的是
A. 化学反应速率:乙>甲 B. 平衡后N2的浓度:乙>甲
C. H2的转化率:乙>甲 D. 平衡混合气中H2的体积分数:乙>甲
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应3A(g)+2B(g)
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,则下列说法正确的是( )
A. 该反应的化学平衡常数表达式是
B. 此时,B的平衡转化率是40%
C. 增大该体系的压强,化学平衡常数增大
D. 增加B,B的平衡转化率增大
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X2(g)+Y2(g)
2Z(g),已知的起始浓度分别为0.1mol/L、0.3 mol/L、 0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A. c(Z)=0.3 mol/L B. c(X2)=0.2mol/L、
C. c(Y2)=0.4 mol/L D. c(X2)+ c(Y2) +c(Z)=0.55 mol/L
难度: 简单查看答案及解析
-
在恒容密闭容器中发生N2(g)+3H2(g)
2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
A. 升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动
B. 升高温度可提高N2转化率
C. 增加H2的浓度,可提高N2转化率
D. 改用高效催化剂,可增大反应的平衡常数
难度: 简单查看答案及解析
-
下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
A. A(s)+B(g)
C(g)+D(g) ΔH>0
B. A2(g)+3B2(g)
2AB3(g) ΔH<0
C. 2AB(g)
A2(s)+B2(g) ΔH>0
D. 2A(g)+B(g)
3C(g)+D(s) ΔH<0
难度: 简单查看答案及解析
-
将气体A2、B2各1 mol充入1 L的密闭容器中反应,生成气体C,一段时间后,测得c(A2)为0.58 mol·L-1,c(B2)为0.16 mol·L-1,c(C)为0.84 mol·L-1,则C的化学式为( )
A. AB B. A2B C. AB2 D. A2B2
难度: 简单查看答案及解析
