-
X、Y、Z、M 是元素周期表中前 20 号元素,其原子序数依次增大,且 X、Y、Z 相邻。X 的核电荷 数是 Y 的核外电子数的一半,Y 与 M 可形成化合物 M2Y。下列说法正确的是( )
A. 还原性:X 的氢化物>Y 的氢化物>Z 的氢化物
B. 简单离子的半径:M 的离子>Z 的离子>Y 的离子>X 的离子
C. YX2、M2Y 都含有极性共价键
D. Z 元素的最高价氧化物的水化物的化学式为 HZO4
难度: 中等查看答案及解析
-
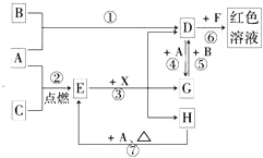
有关Fe2O3及硫酸盐的内容,以下叙述正确的是( )
A. 铝热剂就是指Fe2O3粉和铝粉的混合物
B. 检验从火星上带回来红色物质是否是Fe2O3的操作步骤是:样品→粉碎→ 加水→溶解→过滤→向滤液中滴加KSCN溶液
C. 分别还原a mol Fe2O3所需H2、A1、CO的物质的量之比为3:2:3
D. 明矾属硫酸盐,含结晶水,是混合物
难度: 简单查看答案及解析
-
甲乙两烧杯中分别装有相同体积、相同pH的氨水和NaOH溶液,各加入10mL0.1mol/LA1C13 溶液,两烧杯中都有沉淀生成。下列判断正确的是( )
A. 甲中沉淀一定比乙中多 B. 乙中沉淀可能比甲中的多
C. 甲中沉淀一定比乙中的少 D. 甲中和乙中的沉淀可能一样多
难度: 困难查看答案及解析
-
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是( )
A. 若无固体剩余,则溶液中一定有Fe3+
B. 若溶液中有Cu2+,则一定没有固体析出
C. 若有固体存在,则溶液中一定有Fe2+
D. 若溶液中有Fe2+,则一定有Cu析出
难度: 中等查看答案及解析
-
下列化合物中不能由化合反应直接得到的是( )
A. FeS B. Fe(OH)3 C. FeCl3 D. Al(OH)3
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 质子数相同的原子,其核外电子排布也相同
B. 质量数相同的不同原子,其化学性质一定相同
C. 金属性越强,其原子在反应中越容易失去电子
D. 非金属性越强,其阴离子反应中越容易失去电子
难度: 简单查看答案及解析
-
把一块生锈的铁片投入盛有稀硫酸的烧杯里,待铁片完全溶解后,往烧杯里滴加氢氧化钠溶液至过量, 然后过滤,并充分灼烧不溶物。则最终留下的固体是( )
A. Na2O B. Fe(OH)3 C. Fe2O3 D. Fe2O3 和 NaOH
难度: 中等查看答案及解析
-
X、Y、Z 均为短周期主族元素,X、Y 处于同一周期,X、Z 的最低价离子分别为 X 2 和 Z ,Y 和 Z具有相同的电子层结构。下列说法正确的是( )
A. 原子序数: X Y Z B. 气态氢化物的稳定性: H2X HZ
C. 离子半径: X2 Y Z D. 原子最外层电子数: Y X Z
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是( )
A. 明矾溶液中滴加 Ba(OH)2 溶液至SO42-完全沉淀Al3+ Ba2+ SO42- 3OH- BaSO4 Al(OH)3
B. 将铁粉加入到稀硫酸中:2Fe 6H 2Fe3 3H2
C. 硫酸亚铁酸性溶液中加入过氧化氢: 2Fe2 H2O2 2H 2Fe3 2H2O
D. NaAlO2 溶液中通入过量的 CO2: 2AlO2 3H2OCO2 2Al(OH) CO2-
难度: 中等查看答案及解析
-
由 Al、CuO、Fe2O3 组成的混合物共 10.0g,放入 500mL 某浓度盐酸溶液中,混合物完全溶解,当再 加入 250mL 2.0mol/L 的 NaOH 溶液时,得到的沉淀最多。该盐酸的浓度为( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
难度: 困难查看答案及解析
-
两种短周期元素 X 和 Y 形成的单质能与氢气反应生成 HX 和 HY,反应热分别为 Q1 和 Q2,已知 Q1> Q2,则判断一定正确的是( )
A. 沸点:HY>HX B. 还原性:HY>HX
C. 稳定性:HY>HX D. 酸性:HXO4>HYO4
难度: 中等查看答案及解析
-
在含有Fe3+、Fe2+、AL3+、NH4+的稀溶液中加入足量的Na2O2固体,充分反应后,再加入过量的稀盐酸,反应完全后,离子数目几乎没有变化的是( )
A. Fe3+ B. Fe2+ C. AL3+ D. NH4+
难度: 简单查看答案及解析
-
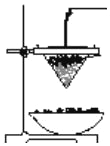
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是

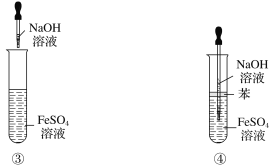
A. ①②③ B. ①②④ C. ①②③④ D. ②③④
难度: 中等查看答案及解析
-
将m g镁铝合金投入到500 mL 2 mol/L的盐酸中,固体完全溶解,收集到气体5.6L(标准状况下)。向反应所得溶液中加入4mol/L的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为
A. 5.10 B. 8.50 C. 9.35 D. 11.48
难度: 困难查看答案及解析
-
X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,下列说法正确的是
A. X的原子半径一定大于Y的原子半径
B. X与Y的简单离子不可能具有相同的电子层结构
C. 两元素形成的化合物中,原子个数比不可能为1 :1
D. X2Y可能是离子化合物,也可能是共价化合物
难度: 中等查看答案及解析
-
向 50mL 稀 H2SO4 与稀 HNO3 的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标 准状况下)之间的关系如图所示,且每一段只对应一个反应。下列说法正确的是( )

A. 参加反应铁粉的总质量 m2=5.6 g
B. 所用混合溶液中 c(HNO3)=0.5 mol•L-1
C. 开始时产生的气体为 H2
D. AB 段产生的反应为置换反应
难度: 中等查看答案及解析