-
关于恒容密闭容器进行的反应C(s)+ CO2(g)= 2CO(g)△H >0,下列说法不正确的是
A. 平衡后再充入一些CO2气体,CO2的转化率将减小。
B. 平衡后再加入一些碳粉,CO2的转化率将增大。
C. 当混合气体的密度不再发生变化时,反应达到平衡状态
D. 达到平衡状态时,升高温度, CO2转化率和反应速率均增大
难度: 中等查看答案及解析
-
化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项
化学反应
测量依据(单位时间内)
A
2NO2
N2O4
颜色深浅
B
Zn+H2SO4=ZnSO4+H2
H2体积
C
CO(g)+H2O(g)=CO2(g)+H2(g)
压强变化
D
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
沉淀质量
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体置于2L的密闭容器中,混合后发生如下反应:2A(g)+ B(g) = 2C(g)。若经2 s后测得C的浓度为1.2 mol/L,下列说法正确是
A. 用物质A表示的反应速率为1.2 mol / (L • s)
B. 用物质B表示的反应速率为0.3 mol / (L • s)
C. 2 s时物质A的转化率为30%
D. 2 s时物质B的浓度为0.6 mol / L
难度: 困难查看答案及解析
-
一定温度下,把 2.5 mol A 和 2.5 mol B混合盛入容积为 2 L的密闭容器里,发生如下反应: 3A(g)+B(g)
x C(g) + 2D(g), 经 5 s反应达平衡,在此 5 s 内 C的平均反应速率为 0.2 mol·L-1·s-1,同时生成1 mol D,下列叙述中不正确的是
A. x=4
B. 达到平衡状态时 A 的物质的量浓度为 c(A)=1.0 mol·L-1
C. 5s 内 B的反应速率 v(B)=0.05 mol·(L·s)-1
D. 达到平衡状态时容器内气体的压强与起始时压强比为 6:5
难度: 困难查看答案及解析
-
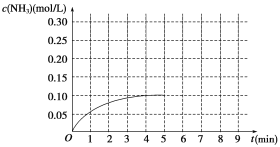
向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g)
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
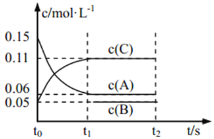
A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡,A的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段,此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)
B(g)+2C(g) ΔH=-50a kJ·mol-1
难度: 困难查看答案及解析
-
在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
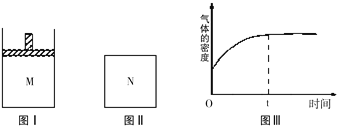
A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
难度: 困难查看答案及解析
-
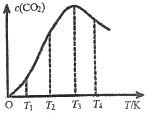
硫化氢分解制取氢气和硫磺的原理为2H2S(g)
S2(g)+2H2(g),在2.0 L恒容密闭容器中充入0.1 mol H2S,不同温度下测得H2S的转化率与时间的关系如图所示。下列说法正确的是
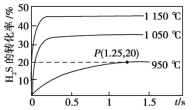
A. 该反应的正反应为放热反应
B. 图中P点:v(正)>v(逆)
C. 950 ℃时,0~1.25 s生成H2的平均反应速率为0.016 mol·L-1·s-1
D. 950 ℃时,该反应的平衡常数值小于3.125×10-4
难度: 困难查看答案及解析
-
2SO2(g)+O2(g)
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
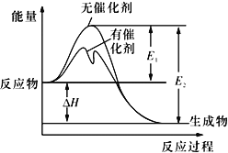
A. 该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B. 500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g)
2SO3(g) ΔH=-2a kJ·mol-l
C. 该反应中,反应物的总键能小于生成物的总键能
D. ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热
难度: 困难查看答案及解析
-
在常温、常压和光照条件下,N2在催化剂表面与H2O发生反应:2N2(g)+6H2O(l) =4NH3(g)+3O2(g)。在2 L的密闭容器中,起始反应物用量相同,催化剂的使用情况也相同,控制不同温度分别进行4组实验,3 h后测定NH3的生成量,所得数据如下表:
实验级别
实验1
实验2
实验3
实验4
温度/K
303
313
323
353
NH3生成量/10−6mol
4.8
5.9
6.0
2.0
下列说法不正确的是
A. 温度为303 K时,在3 h内用氮气表示的平均反应速率为4×10−7mol·L−1·h−1
B. 实验1和实验3中,3 h内N2的转化率之比为4:5
C. 分析四组实验数据可得出,温度升高可加快反应速率,也可能减慢反应速率
D. 353 K时,可能是催化剂催化活性下降或部分水脱离催化剂表面,致使化学反应速率减慢
难度: 困难查看答案及解析
-
下列事实不能用勒夏特列原理(平衡移动原理)解释的是
①溴水中存在化学平衡:Br2+H2O
HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅
②铁在潮湿的空气中易生锈
③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深
④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)
K(g)+NaCl(l)
⑥反应CO(g)+NO2(g)
CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深
A. ①④ B. ②③ C. ②⑥ D. ②③⑥
难度: 中等查看答案及解析
-
将NO2装入带活塞的密闭容器中,当反应2NO2(g)
N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是
A. 升高温度,气体颜色加深,则此反应为吸热反应
B. 慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C. 慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D. 恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
难度: 中等查看答案及解析
-
在一密闭容器中,aA(g)
bB(g)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新的平衡时,B的浓度是原来的60%,则
A. 平衡向正反应方向移动了 B. 物质A的转化率减小了
C. 物质B的质量分数增大了 D. a>b
难度: 中等查看答案及解析
-
下列叙述及解释正确的是
A. 2NO2(g)(红棕色)
N2O4(g)(无色) ΔH<0,在平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅
B. H2(g)+I2(g)
2HI(g) ΔH<0,在平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变
C. FeCl3+3KSCN
Fe(SCN)3(红色)+3KCl,在平衡后,加少量KCl,因为平衡向逆反应方向移动,故体系颜色变浅
D. 对于N2+3H2
2NH3,平衡后,压强不变,充入O2,平衡左移
难度: 中等查看答案及解析
-
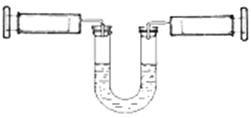
下图A、B是等体积容器,K是开关,活塞可以左右移动。在一定温度下,关闭K,向A中通入一定量的NO2。发生:2NO2(g)
N2O4(g);△H<0。则以下说法不正确的是
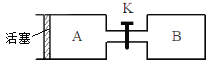
A. 保持活塞位置不变,打开K,体系中气体颜色先变浅、然后略加深
B. 打开K一会,再关闭它,向右推动活塞,最后A容器的气体颜色比B的浅
C. 保持活塞位置不变,打开K一会,再关闭它,把A容器加热,A中气体颜色比B中深
D. 打开K一会,再关闭它,向B中通入氩气,B中气体颜色不变
难度: 困难查看答案及解析
-
反应:①PCl5(g)
PCl3(g)+Cl2(g) ②2HI(g)
H2(g)+I2(g) ③2NO2(g)
N2O4(g),在一定条件下,达到化学平衡时,反应物的转化率均是 a%。若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率
A. 均不变 B. ①增大,②不变,③减少
C. 均增大 D. ①减少,②不变,③增大
难度: 简单查看答案及解析