-
化学与科学、技术、社会、环境密切相关。下列有关说法中正确的是
A. 现代化学的重要任务之一是利用化学反应创造新的原子合成新的物质
B. 雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒直径不相同
C. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
D. 在次氯酸钠溶液中通入少量二氧化硫可使其消毒能力增强
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 0.1mol/LA1O2-溶液中:Na+、K+、SO32-、CO32-
B. 在含0.1mol/LHClO溶液中:Cu2+、Fe2+、Cl-、SO42-
C. 在pH=7的某透明溶液中:Fe3+、Ca2+、NO3-、Cl-
D. 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32-
难度: 中等查看答案及解析
-
下列除杂试剂的选择或除杂操作正确的是
选项
括号内为杂质
除杂试剂
除杂操作
A
CO2(SO2)
Na2CO3溶液.
将气体通过足量的Na2CO3溶液
B
Na2O2(Na2O)固体
O2
在纯氧气中加热
C
FeCl3溶液(CuCl2)
Fe粉
加入过量Fe粉,充分反应后过滤
D
Na2SO4溶液(Na2CO3)
盐酸
加入盐酸至不再产生气泡为止
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列有关化学现象和化学概念表述正确的是
A. 由于四氯化碳的沸点高,所以四氯化碳可用于灭火
B. Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C. 鉴定FeCl3溶液中含有FeCl2可以滴加酸性KMnO4溶液,若褪色,则证明有FeCl2
D. 1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
难度: 中等查看答案及解析
-
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O==NaBO2+4H2↑,下列说法中正确的是
A. NaBH4中H的化合价为+1价
B. NaBH4是氧化剂,H2O是还原剂
C. 被氧化的元素与被还原的元素质量之比为1:1
D. 3.8g NaBH4充分反应,放出8.96LH2
难度: 中等查看答案及解析
-
将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.
 B.
B. 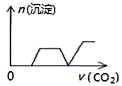
C.
 D.
D. 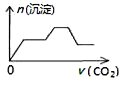
难度: 中等查看答案及解析
-
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。某校课外兴趣小组以两条途径分别对X进行如下实验探究,下列有关说法正确的是
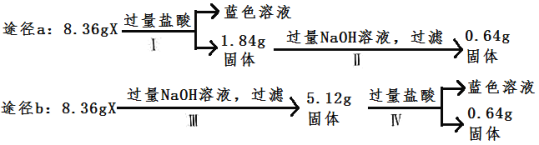
A. 由图可知X中一定存在Fe2O3
B. 不可以判断混合物中是否含有Al2O3
C. 混合物X中含0.64gCu
D. Ⅰ中发生的反应的离子方程式为Cu+2H+=Cu2++H2↑
难度: 中等查看答案及解析

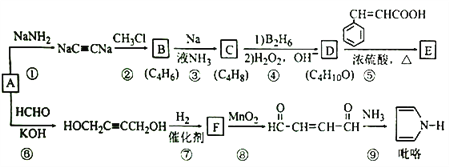
 )的同分异构体中,含有苯环和碳碳双键,且能够NaHCO3反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有两组峰且面积比为2:3的有机物的结构简式是___________。
)的同分异构体中,含有苯环和碳碳双键,且能够NaHCO3反应的共有_____种(不考虑顺反异构)。与D互为同分异构体,且核磁共振氢谱有两组峰且面积比为2:3的有机物的结构简式是___________。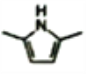 )的合成路线___________。
)的合成路线___________。