-
中国不少古诗词清晰描绘了当时人民的生活和社会的发展,如刘禹锡的浪淘沙“日照澄州江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识正确的是
A. “沙中浪底来”指的是金的氧化物 B. 淘金原理与化学上的萃取一致
C. 雾的分散质粒子直径范围是1-100nm D. 沙子的主要成分是Si
难度: 简单查看答案及解析
-
下列试剂的保存方法中错误的是
A. 少量的钠保存在煤油中
B. 氢氟酸保存在玻璃瓶中
C. 新制的氯水保存在棕色玻璃瓶中
D. NaOH溶液保存在带橡皮塞的玻璃瓶中
难度: 简单查看答案及解析
-
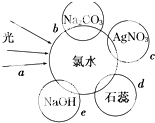
化学与生产、生活密切相关。下列与化学相关的说法正确的是
A. 医用酒精和Fe(OH)3胶体可用丁达尔效应区分
B. 水泥、水玻璃、水晶均属于硅酸盐产品
C. 氯水和食盐水消毒杀菌的原理相同
D. 盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
难度: 中等查看答案及解析
-
下列物质的电子式书写正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中可能大量共存的是( )
A. pH=1的溶液中:Na+、K+、MnO4-、CO32-
B. 无色溶液中:Cu2+、Al3+、NH4+、Cl-
C. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Mg2+、Cu2+、SO42-、NO3-
D. 0.1mol·L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A. 向FeCl2溶液中通入Cl2:2Fe2++Cl2═2Fe3++2Cl﹣
B. Ba(OH)2溶液与硫酸反应:OH﹣+H+═H2O
C. 次氯酸钙溶液中通入少量SO2:2ClO﹣+Ca2++SO2+H2O═CaSO3↓+2HClO
D. 碳酸氢钠溶液中加入过量石灰水:2HCO3﹣+Ca2++2OH﹣═CaCO3↓+2H2O+ CO32-
难度: 中等查看答案及解析
-
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应
Fe2O3+3Na2O2=2Na2FeO4+Na2O,下列说法正确的是
A. Na2O2既是氧化剂又是还原剂
B. Fe2O3在反应中得到电子
C. 3 mol Na2O2发生反应,有12 mol e-发生转移
D. Na2FeO4能消毒杀菌是因其具有强氧化性
难度: 中等查看答案及解析
-
有关Na2CO3和NaHCO3的性质,下列叙述错误的是
A. 相同温度下,等浓度的Na2CO3和NaHCO3溶液的碱性比较,前者更强
B. 常温时水溶性:Na2CO3>NaHCO3
C. 在酒精灯加热的条件下,前者不分解,后者分解
D. 将澄清石灰水分别加入Na2CO3和NaHCO3溶液中,前者产生沉淀,后者无现象
难度: 困难查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
Al(OH)3用作塑料的阻燃剂
Al(OH)3受热熔化放出大量的热
B
用 淀粉-KI溶液鉴别FeCl2 和FeCl3
Fe2+ 有氧化性
C
CuSO4 可以用作游泳池消毒
铜盐能使蛋白质变性
D
盐酸和氨水能溶解Al(OH)3
Al(OH)3 是两性氢氧化物
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
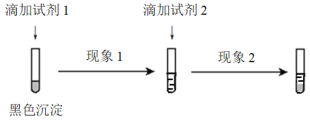
下列实验中的颜色变化,与氧化还原反应无关的是
选项
A
B
C
D
实验
NaOH溶液滴入FeSO4溶液中
石蕊溶液滴入氯水中
KSCN溶液滴入FeCl3溶液中
CO2通过装有Na2O2固体的干燥管
现象
产生白色沉淀,随后变为红褐色
溶液变红,随后迅速褪色
溶液变为红色
固体由淡黄色变为白色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对实验Ⅰ~Ⅳ的实验操作现象判断正确的是

A. 实验Ⅰ:产生红褐色沉淀
B. 实验Ⅱ:溶液颜色变红
C. 实验Ⅲ:放出大量气体
D. 实验Ⅳ:先出现白色沉淀,后溶解
难度: 简单查看答案及解析
-
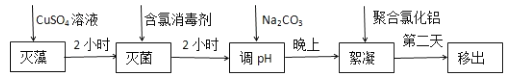
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如图所示:
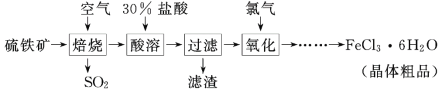
下列说法不正确的是
A. 酸溶过程使用的酸也可以是硝酸,且过量
B. 为了防止污染,焙烧过程中产生的SO2要回收利用
C. 通氯气的目的是氧化Fe2+
D. 由FeCl3·6H2O制取无水FeCl3需要在氯化氢的气流中加热
难度: 中等查看答案及解析
-
下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
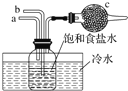
A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
难度: 简单查看答案及解析
-
常温下,二氯化二硫(S2Cl2)为橙黄色液体,遇水易水解,工业上用于橡胶的硫化。某学习小组用氯气和硫单质合成S2Cl2的实验装置如图所示.下列说法正确的是
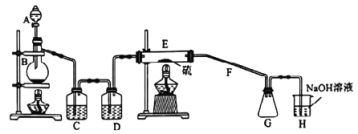
A. 实验时需先点燃E处的酒精灯
B. C、D中所盛试剂为饱和氯化钠溶液、浓硫酸
C. 二氯化二硫(S2Cl2)水解反应产物为:S、H2S、HCl
D. G中可收集到纯净的产品
难度: 困难查看答案及解析