-
pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比( )
A. 11 :1 B. 9 :1 C. 1 :11 D. 1 :9
难度: 简单查看答案及解析
-
室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)=CuSO4(s)+5H2O(l),热效应为△H3。则下列判断不正确的是 ( )
A. △H2<△H3 B. △H1<△H3 C. △H2+△H3 =△H1 D. △H1+△H2>△H3
难度: 简单查看答案及解析
-
室温下,甲、乙两烧杯均盛有5mL pH=2的某一元酸溶液,向乙烧杯中加水稀释至pH=3。关于甲、乙两烧杯中溶液的描述正确的是 ( )
A. 溶液的体积:10V甲=V乙
B. 水电离出的C(OH-):10C(OH-)甲≤C(OH-)乙
C. 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲≥乙
D. 若分别与5mL pH=12的NaOH溶液反应,所得溶液的pH:甲≥乙
难度: 中等查看答案及解析
-
设NA为阿伏加徳罗常数的值,下列说法正确的是 ( )
A. 1LpH=2的硫酸溶液中SO42-数目等于0.01NA
B. 室温下,pH=6的NH4Cl溶液中,由水电离的H+浓度为10-6mol/L
C. 常温下,1mol/L盐酸溶液中H+个数等于0.1NA
D. 在密闭容器内充入0.50molNO和0.25molO2,充分反应后容器内分子数为0.5NA
难度: 中等查看答案及解析
-
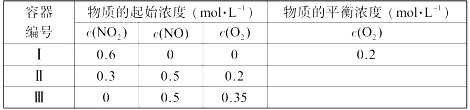
物质的量浓度相同的以下溶液:①NH4HSO4 ②(NH4)2CO3 ③NH4Fe(SO4)2 ④NH4NO3 ⑤CH3COONH4,c(NH4+)由大到小的顺序为
A. ②①③④⑤ B. ③①④②⑤ C. ①③④⑤② D. ②①④⑤③
难度: 中等查看答案及解析
-
合成氨反应为:3H2+N2
2NH3,其反应速率可以分别用v(H2)、v(N2)、v(NH3)表示,反应达平衡时,下列关系式正确的是 ( )
A. 3v(H2)正=v(N2)逆 B. v(H2)生成=v(NH3)生成
C. 2v(N2)消耗=v(NH3)消耗 D. 3v(H2)逆=2v(NH3)正
难度: 中等查看答案及解析
-
反应2X(气)+Y(气)=2Z(气)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示。下列判断正确的是
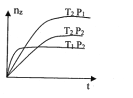
A. T1<T2 P1<P2 B. T1<T2 Pl>P2
C. T1>T2 P1>P2 D. T1>T2 P1<P2
难度: 中等查看答案及解析
-
在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
难度: 困难查看答案及解析
-
常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×10−5。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
难度: 困难查看答案及解析
-
若室温时pH=a的氨水与pH=b的盐酸等体积混合,恰好完全反应,则该氨水的电离度可表示为( )
A. 10(a+b-12)% B. 10(a+b-14)% C. 10(12-a-b)% D. 10(14-a-b)%
难度: 中等查看答案及解析
-
室温下,向下列溶液中通入相应的气体至溶液pH=7(忽略溶液体积的变化),溶液中部分微粒的物质的量浓度不正确的是 ( )
A. 向0.20 mol/L NH4HCO3中通入CO2: C(NH4+)=C(HCO3-)+2C(CO32-)
B. 向0.15 mol/L NaHSO3中通入NH3: C(Na+)>C(NH4+)>C(SO32-)
C. 向0.30mol/L Na2SO3中通入CO2: C(Na+)=2[C(SO32-)+C(HSO3-)+C(H2SO3)]
D. 向0.10 mol/L CH3COONa中通入HCl:C(Na+)>C(CH3COOH)=C(Cl-)
难度: 困难查看答案及解析
-
在恒容密闭容器中通入X并发生反应:2X(g)
Y(g),温度T1、T2下X的物质的量浓度C(X)随时间t变化的曲线如图所示,下列叙述正确的是( )

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2 下,在 0〜t1时间内,v(Y)=b/t1 mol·L-1·min-1
C. M点的正反应速率v 正大于N点的逆反应速率v逆
D. M点时再加入一定量X,平衡后X的转化率减小
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是 ( )
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中(c(CH3COO-))/(c(CH3COOH)⋅c(OH-))增大
C. 向盐酸中加入氨水至中性,溶液中(c(NH4+))/(c(Cl-))>1
D. NH4HSO4和NaOH混合呈中性C(Na+)>C(SO42—)>C(NH4+)>C(NH3·H2O)>C(H+)=C(OH—)
难度: 中等查看答案及解析
-
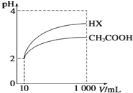
常温下,在20.0mL0.10mol•L-1氨水中滴入0.10mol•L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )
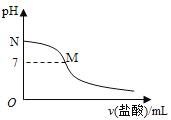
A. 该滴定过程应该选择甲基橙作为指示剂
B. M点对应的盐酸体积大于20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
D. N点处的溶液中pH小于12
难度: 困难查看答案及解析
-
下列应用与盐类的水解无关的是 ( )
A. 纯碱溶液可去除油污 B. NaCl可用作防腐剂和调味剂
C. TiCl4溶于大量水加热制备TiO2 D. FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体
难度: 中等查看答案及解析
-
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中正确的是( )
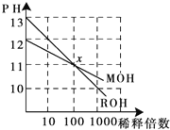
A. ROH是一种弱碱 B. 在x点,c(M+)=c(R+)
C. 在x点,MOH完全电离 D. 稀释前,c(ROH)=10 c(MOH)
难度: 中等查看答案及解析
-
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是 ( )
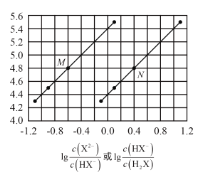
A. 己二酸电离常数Ka1(H2X)约为10-4.4
B. 曲线M表示pH与lg(HX—)/(H2X)的变化关系
C. 当溶液中c(X2-)=c(HX-)时,溶液为碱性
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2—)>c(OH—)=c(H+)
难度: 困难查看答案及解析