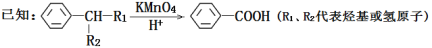
-
化学与生产、生活、技术密切关。下列说法错误的是
A. “疫苗”等生物制剂需要冷冻保存 B. 明矾和二氧化氯处理水,原理相同
C. 用氢氟酸可进行玻璃雕刻 D. 小苏打和氢氧化铝均可用于中和胃酸
难度: 简单查看答案及解析
-
明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底辅薪,发火煅红,……冷淀,毁罐取出,……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是
A. 倭铅就是金属锌
B. 该冶炼锌的方法属于热还原法,煤炭中起作用的主要成分是C
C. 冶炼Zn的反应方程式为ZnCO3+2C
Zn+3CO↑
D. 能用类似于此方法冶炼的金属有:Mg、Fe、Cu
难度: 简单查看答案及解析
-
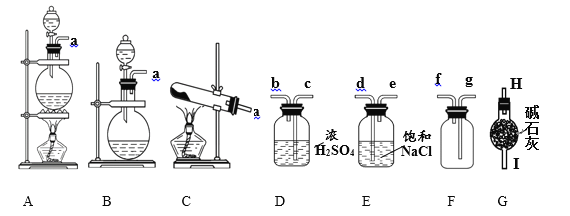
对于下图所示实验,下列实验现象预测或操作正确的是
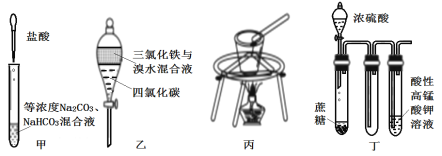
A. 实验甲:匀速逐滴滴加盐酸时,试管中没气泡产生和有气泡产生的时间段相同
B. 实验乙:充分振荡后静置,下层溶液为橙红色,上层为无色
C. 实验丙:将MgCl2•6H2O置于坩埚中加热以制备无水MgCl2
D. 装置丁:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A. 常温下,1 L 1 mol·L−1 Na2CO3溶液中,阴离子数目小于NA
B. 标准状况下,2 mol SO2和1 mol O2充分反应生成SO3的数目为2NA
C. 6.2 g Na2O和7.8 g Na2O2阴离子数目均为0.1 NA
D. 标准状况下,22.4 L Cl2完全参加反应,转移电子的数目一定为2NA
难度: 中等查看答案及解析
-
A、B、C、D、E几种元素中,A与D同主族,B、C、D、E同周期,B形成的单质能在A形成的单质中燃烧,生成强氧化性化合物,C的单质能溶于D的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液,E的最高价氧化物对应的水化物和气态氢化物水溶液都是强酸。则下列说法不正确的是
A. 氢化物的稳定性和沸点:A>D,氧化物对应水化物酸性强弱:E>D
B. 一定条件下,铁分别与D、E形成的单质反应,产物中铁的价态不同
C. B、C、D的最高价氧化物的水化物可两两反应生成盐类物质
D. 工业上,将C的氧化物和B的一种化合物共融电解生产C的单质
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A
制备H2SiO3胶体。
向Na2SiO3溶液中滴入过量的盐酸,并充分振荡。
B
证明HClO和H2CO3的酸性强弱。
用pH试纸测定浓度均为0.1mol/L的NaClO溶液和NaHCO3溶液的pH。
C
检验FeCl3溶液中是否含有Fe2+。
取少量溶液于试管中,再滴入K3Fe(CN)6溶液。
D
证明H2O2的氧化性比Fe3+强。
将稀硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中。
A. A B. B C. C D. D
难度: 中等查看答案及解析